Физико-химические свойства углеводородных газов
К основным параметрам газа относятся: молекулярная масса, плотность, сжимаемость, вязкость, а также упругость насыщенных паров.
Газ является наиболее совершенным видом топлива. Он обладает высокой теплотой сгорания. Устройство топок для сжигания газа сравнительно простое. Воздух не загрязняется дымом и копотью.
Молекулярная масса газа представляет собой сумму молекулярных масс атомов, входящих в молекулу газов. Масса газа в граммах, численно равная его молекулярной массе, называется молем. Если известен мольный, т.е. объемный, состав смеси газа в процентах, то средняя молекулярная масса его
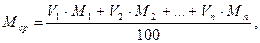
где V1, …Vn - мольные (объемные) концентрации компонентов,
%; M1, … Mn - молекулярные массы компонентов.
Плотность газа (кг/м3) определяется отношением массы к объему:
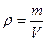
где т — масса газа, кг; V— объем данной массы газа, м3.
Большинство горючих газов (водород, метан и др.) легче воздуха, а некоторые газы (пропан, бутан и др.) тяжелее. Этот показатель характеризуется понятием относительной плотности. Относительной плотностью газа называется отношение массовой единицы объема газа к массе такой же единицы объема сухого воздуха при одинаковых условиях (t и р)
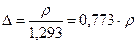 ,
,
где 1,293 кг/м3 – плотность сухого воздуха.
Поскольку плотность р зависит от давления, температуры и сжимаемости газа, плотность p1 соответствует давлению Р1 и температуре Т1, то пересчет ее на другие давления Р2 и температуру Т2 производится по формуле
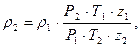
где Т1, Т2 — температура; z1 и z2 — коэффициенты сжимаемости газа соответственно при Р1 и Т1, а также при Р2 и Т2. Так как объем одного моля газа при данных значениях температуры и давления является величиной постоянной для всех газов (закон Авогадро), то плотности их прямо пропорциональны молекулярным массам
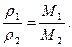
Плотность газа при 0 °С и данном значении молекулярной массы определяют из выражения
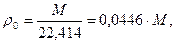
где 22,414 м3 — объем 1 кмоля любого газа (0 °С и 760 мм рт. ст.).
Смеси газов.Плотность газовых смесей определяют по правилу смешения, согласно которому свойства смеси складываются пропорционально из свойств компонентов, входящих в смесь
РСМ = а1 · р1 + а2 · р2 + …+ аn · pn,
где рсм — плотность смеси газов, кг/м3; а1 ,...аn — объемные концентрации (в долях единицы) компонентов смеси; p1, … pn -плотность компонентов.
Сжимаемость газовхарактеризуется коэффициентом, учитывающим отклонение реальных газов от законов идеального газа. Коэффициент сжимаемости z газов определяют экспериментально, а при отсутствии этих данных — по номограммам.
Критической температуройназывают температуру, выше которой газ не переходит в жидкое состояние, как бы ни повысили его давление (бутан — 152 °С, воздух — 142 °С, метан — 82 °С).
Критическим давлениемназывают такое давление, ниже которого газ не переходит в жидкое состояние, как бы ни понизили его температуру (воздух — 3,8 МПа, бутан — 3,5 МПа).
Среднекритические параметры газовой смеси определяют по правилам смешения:
—для среднекритической температуры (в К)
Tкр.см. = а1 · Ткр1 + а2 · Ткр2 + … + аn · Tкр.n;
- для среднекритического давления (вПа)
Ркр.см.=а1 · Ркр1 + а2 · Ркр2 + … + аn ·Pкр.п.
Вязкость газа характеризует свойство газа оказывать сопротивление сдвигающим усилиям возникающим в результате сил трения между слоями движущееся газа Коэффициент, учитывающий это свойство реальных газов и характеризующий пропорциональное отношение действующей силы сдвига, отнесенной к единице поверхности соприкасающихся слоев, называется коэффициентом динамической вязкости(Па-с)
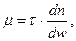
где τ — напряжение внутреннего трения, Па; n — расстояние по нормам к направлению линейной скорости газа, м; w — линейная скорость газа, м/с.
При гидравлических расчетах пользуются понятием кинематической вязкости (м2/с)
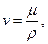
где р — плотность, кг/м3.
Вязкость газа не подчиняется правилу смешения, ее определяют по эмпирическим формулам (при t = 20 °С):
— для динамической вязкости
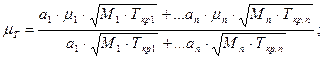
— для кинематической вязкости
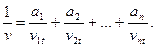
При температуре, отличающейся от + 20 °С (—10 до + 40 °С) кинематическая вязкость определяется из выражения
vr=v20 · [l + 0,006 · (t - 20)];
где v20 и vt — кинематические вязкости газовых смесей соответственно при 20 °С и 0,1 МПа и при температуре газа t.
Теплоемкость. Теплоемкостью называется количество тепла, необходимого для нагревания на 1 К газа, взятого в количестве одной весовой или объемной единицы. Различают весовую и объемную теплоемкости газов. Весовая измеряется в килоджоулях на килограмм-градус Кельвина кДж/(кг · К), объемная — в килоджоулях на кубический метр-градус Кельвина кДж/(м3 · К).
В зависимости от условий нагревания газа различают теплоемкость Ср при постоянном давлении (газ при нагревании в свободно расширяющемся сосуде расширяется, сохраняя постоянное давление) и теплоемкость Cv при постоянном объеме (газ нагревается в сосуде постоянного объема). Эти две величины связаны между собой следующим соотношением
Cp-CV=A· R,
где А = 1/427 - тепловой эквивалент работы; R = 8,4 Дж/(моль · К) — газовая постоянная; Cp>Cv на величину внешней работы, которую совершает нагреваемый газ при расширении.
Теплота сгоранияоценивает газ как топливо. Она равна количеству тепла, выделяющегося при сжигании единицы веса или единицы объема газа.
Упругость насыщенных паровопределяется по закону Дальтона — Рауля. Давление, при котором жидкость при данной температуре находится в равновесном состоянии со своими парами, называется упругостью насыщенных паров жидкости. Каждой жидкости соответствует своя упругость паров. Кривая изменения давления от температуры называется кривой испарения. По закону Дальтона (закону парциальных давлений) давление газовой смеси равно сумме давлений компонентов, входящих в смесь:
P = P1 + P2 + …+ Pn = 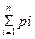
Каждый компонент, обладая собственной упругостью (давлением), по объему равен объему смеси и приводится к общему давлению по закону Бойля-Мариотта
vi · P = V·pi,
где vi — парциальный объем компонента; Р — общее давление газовой смеси; V — общий объем газовой смеси; pi — парциальное давление компонента.
Парциальнымназывается давление каждого газа в смеси нескольких газов, которое он имел бы, если бы один занимал весь объем смеси.
Pi = xi · Pуi
где 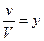 — объемная или молекулярная концентрация.
— объемная или молекулярная концентрация.
Дата добавления: 2016-01-26; просмотров: 2025;
