ФМН – флавинмононуклеотид
| флавин | — | рибитол | — | Ф(н) |
| (B2) |
5) HS – коэнзим А (HS – КоА)
| тиоламин | — | пантотеновая кислота | — | аденозиндифосфат |
| (B3) |
У ОКФ роль активного центра выполняет часть белковой молекулы. Это уникальное сочетание определенных аминокислот. Активный центр возникает в тот момент, когда белок-фермент приобретает определенную специфическую 3-ю структуру. Чаще в активный центр входят аминокислоты: сер, гис, асп, глу, арг, цис, тир, три. Они располагаются в разных точках полипептидной цепи и оказываются поблизости (в одной области) при складывании цепи.
Кроме активного центра у ферментов различают ещё 2 центра: субстратный и аллостерический.
Субстратный центр – участок молекулы фермента, ответственный за присоединение субстрата. Здесь аминокислоты: лиз, глу, цис.
Аллостерический центр – участок молекулы фермента, при присоединении к которому низкомолекулярного вещества изменяется 3-я структура. А, следовательно – каталитическая активность фермента.
2-й вопрос.
Ферменты – биокатализаторы, по ряду признаков отличаются от неорганических катализаторов, хотя они, как и неорганические катализаторы, не вызывают новых реакций, а лишь ускоряют существующие.
1. Интенсивность действия. Ферменты в отличие от неорганических катализаторов работают очень интенсивно.
Пример: а) кислотный гидролиз белка идет при t о 100оС за несколько часов;
б) ферментативный гидролиз белка идет при t о 40о за несколько минут;
а) кислотный гидролиз крахмала проходит при tо 100о за несколько часов;
б) ферментативный гидролиз крахмала проходит при tо 40о за несколько секунд.
2. Ферменты обладают специфичностью действия. Каждый фермент ускоряет одну реакцию или реакции одного типа.
Пример: каталаза – только распад Н2О2; амилаза – гидролиз крахмала; дегидрогеназа – реакции окисления, т.е. отделения Н2.
3. Ферменты работают в мягких условиях (низкая температура, нормальное давление, невысокое значение pH-среды). В этом правиле есть и исключения. Каталаза работает при температуре от 0°С до 10°С, а миокиназа – до 100°С. Пепсин работает при pH среды от 1,5 до 2, а аргиназа – до 9,9.
|
|
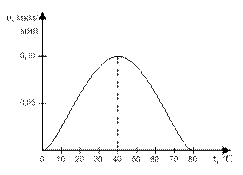
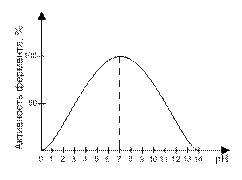
4. На активность ферментов влияют активаторы и ингибиторы. Например, NaCl активирует фермент амилазу:
| ||||||
| NaCl |  амилаза амилаза
| гидролизует | крахмал | |||
| ||||||
 
| 
| |||||
| HCl | пепсин | гидролизует | белок | |||
| ||||||
| желчь | липаза | гидролизует | жир |
5. Все процессы ферментативного катализатора представляют собой серию превращений, многоступенчатый процесс. Жесткая запрограммированность этапов действия – вот что отличает биокатализаторы от неорганических катализаторов.
3-й вопрос.
Ферменты, переваривающие белок пищи, – протеолитические: пепсин, трипсин, химотрипсин. Они вырабатываются в неактивной форме – проферменты (зимогены). Затем при определенных условиях превращаются в активные. Поэтому вырабатывающие их ткани не подвергаются самоперевариванию.
Н+ (НCl)
 Пепсиноген пепсин + полипептид
Пепсиноген пепсин + полипептид
М = 42 000 (в полости М = 35 000 М = 7 000
(в стенке желудка) желудка) (он блокировал акт.центр)
энтерокиназа
 трипсиноген трипсин + гексапептид
трипсиноген трипсин + гексапептид
(в поджелудочной (в тонком изменение (вал, 4асп, лиз)
железе) кишечнике) 3-й стр-ры
трипсин
 химотрипсиноген химотрипсин
химотрипсиноген химотрипсин
(в тонком кишечнике)

| |||||

| |||||
| NH2 | 
| COOH | |||
Эти ферменты обладают специфичностью действия (выборочный, селективный характер действия). Они ускоряют гидролиз пептидных связей в молекуле белка между определенными аминокислотами:
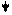
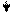
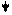
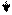
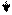
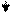 Пепсин трипсин химотрипсин
Пепсин трипсин химотрипсин
-фен – лей - - арг – лиз - - фен – тир – три –
У растений фермент папаин гидролизует связи, образованные аминокислотами: арг, лиз, фен.
4-й вопрос.
Из известных более 2500 ферментов каждый имеет свое название.
1. Тривиальная номенклатура. Имена ферментам давали по случайным признакам. Например, «пепсин» – «разжижаю», «трипсин» – «перевариваю».
2. Рациональная номенклатура. Названия ферментам стали давать по названию субстрата действия данного фермента с добавлением окончанием «-аза». Например, сахароза (субстрат) – сахараза (фермент), лактоза – лактаза, крахмал – амилаза.
3. Систематическая номенклатура.Название ферменту давали по типу катализируемой реакции.
а) Дегидрогеназа – фермент, отделяющий водород, то есть происходит окисление.
| COOH | COOH | |||||
| | | 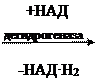
| | | ||||
| CH2 | CH | |||||
| | | || | |||||
| CH2 | CH | |||||
| | | | | |||||
| COOH | COOH | |||||
| янтарная кислота (сукцин) | фумаровая кислота (фумарат) | |||||
б) Декарбоксилаза – фермент, отделяющий карбоксильную группу.
| O | ||||||||||
| CH3 | — | C | — | COOH | 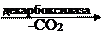
| || | ||||
| || | CH3 | — | C | |||||||
| O | | | |||||||||
| H | ||||||||||
| ПВК (пируват) | альдегид уксусной кислоты |
4. Научная номенклатура.Она была принята в 1961 году на пятом Международном биохимическом конгрессе. То есть в названии фермента указывается субстрат, акцептор и тип катализируемой реакции. Например, α-аланин-α-кетоглутарат-аминотрансфераза:
| COOH | COOH | |||||||||||
| | | | | |||||||||||
| COOH | αC = O | COOH | CH — NH2 | |||||||||
| | | | |
| | | | | ||||||||
| αCH | — | NH2 | + | CH2 | 
|  C C
| O | + | CH2 | |||
| | | | | | | | | |||||||||
| βCH3 | CH2 | CH3 | CH2 | |||||||||
| | | | | |||||||||||
| COOH | COOH | |||||||||||
| α-аланин | α-кетоглутарат | ПВК | глутаминовая к-та |
На этом же конгрессе была принята классификация ферментов, согласно которой все ферменты делят на шесть классов. Составлен общий список известных ферментов. Каждому ферменту в этом списке дан индивидуальный номер (шифр). Примеры: уреаза – 3.5.1.5; лактатдегидрогеназа – 1.1.1.27.
Оксидоредуктазы.
Ферменты этого класса катализируют реакции окисления-восстановления, участвуют в биологическом окислении (тканевом дыхании). Окисление (дегидрирование) – процесс отнятия атомов Н (Н+е-) от субстрата. Восстановление – процесс присоединения атомов Н (Н+е-) к акцептору.
Оксидоредуктазы образуют системы (цепи) дыхательных ферментов, в которых осуществляется многоступенчатый перенос атомов Н (или Н+, е-) от субстрата к акцептору. Конечным акцептором Н в клетках как правило является О2, в результате образуется Н2О.
В природных объектах обнаружено более 500 оксидоредуктаз. Это Д.К.Ф. Они отличаются коферментом и апоферментом. К ним относятся: дегидрогеназы, флавопротеины, цитохромы, пероксидаза, каталаза.
а) Дегидрогеназы – Д.К.Ф. Кофермент НАД или НАДФ. Это первичные дегидрогеназы – осуществляют отнятие Н от окисляемого субстрата
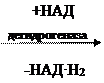
| |||||||||||
| CH3 | — | CH | — | COOH | CH3 | — | C | — | COOH | ||
| | | || | ||||||||||
| OH | O | ||||||||||
| молочная кислота | ПВК |
б) Флавиновые ферменты – Д.К.Ф. Их кофермент – рибофлавин – ФАД, ФМН (Вит.В2). Их функция – перенос Н от восстановленных форм дегидрогеназ (НАД.Н2 и НАДФ.Н2) к цитохромам, т.е. они – вторичные дегидрогеназы.
В) Цитохромы – Д.К.Ф. Их коферменты – гем (Fe+2). Их несколько типов, отличаются апоферментом. Сейчас известно несколько десятков цитохромов, их обозначают латинскими буквами: а1, а2, а3, b1, b2, b3, c, d…
Цитохромы способны переносить только е-, снятые с Н от флавопротеинов. Они переносят е- на О и его ионизируют, последний, соединяясь с Н+, образует Н2О. Из всех цитохромов только а3 передает е-на О2. Он называется цитохромоксидаза (он в геме кроме Fe2+ содержит также Cu2+).
Г) Пероксидазы (каталаза) – Д.К.Ф. Кофермент – гем (Fe3+).Отличаются апоферментом. Различие в функциях пероксидазы и каталазы объясняется разницей белковой части. Субстрат их действия – пероксид водорода:
пероксидаза
 Н2О2 2 Н2О + О
Н2О2 2 Н2О + О
каталаза
 2 Н2О2 2 Н2О + О2
2 Н2О2 2 Н2О + О2
Каталаза и пероксидаза содержатся в тканях животных, в молоке, крови, много в растениях.
2. Трансферазы.Ускоряют перенос групп атомов от одной молекулы к другой. В зависимости от того, какую группу они переносят, различают: аминотрансферазы, фосфотрансферазы, метилтрансферазы, ацилтрансферазы, гликозилтрансферазы.
а) Аминотрансфераза
| COOH | COOH | |||||||||||||||
| COOH | | | COOH | | | |||||||||||||
| | |  C C
| O |
| | | CH | — | NH2 | |||||||||
| CH | — | NH2 | + | | | 
|  C C
| O | + | | | |||||||
| | | CH2 | | | CH2 | |||||||||||||
| CH3 | | | CH3 | | | |||||||||||||
| COOH | COOH | |||||||||||||||
| аланин | щавелево- | ПВК | аспарагиновая кислота | |||||||||||||
| уксусная кислота |
фосфотрансфераза
 б) АТФ + глюкоза АДФ + глюкозо-6-фосфат
б) АТФ + глюкоза АДФ + глюкозо-6-фосфат
(гексокиназа)
- n АДФ
Метилтрансферазы – переносят -СН3; ацилтрансферазы – ацильные остатки жирных кислот; гликозилтрансферазы – гликозильные остатки при синтезе олиго- и полисахаридов.
3. Гидролазы.Ферменты ускоряют реакции гидролиза, то есть распад веществ (кроме С-С- связей) при участии воды. Сюда относятся: эстеразы, глюкозидазы, пептидазы, амидазы, фосфатазы.
а) Гидролиз жира

| O | |||||||||||||||||
| CH2 | — | O | — | C | — | R1 | CH2 | — | OH | |||||||||
| | | 
| O |
| | | ||||||||||||||
| CH | — | O | — | C | — | R2 | + | H2O | 
| CH | — | OH | + | 3R | — | COOH | ||
| | | 
| O | | | |||||||||||||||
| CH2 | — | O | — | C | — | R3 | CH2 | — | OH | |||||||||
| жир | глицерин | жирная к-та | ||||||||||||||||
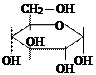
б) Гидролиз углеводов
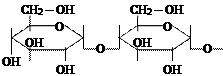
| 
| |||||||
| ||||||||
| … | + | H2O | 
| n | ||||
| крахмал | α-глюкоза |
в) Гидролиз белка
| O | 
| H |  O O
| H | |||||||||||||||||||||||
| || | | | || | | |
| |||||||||||||||||||||||
| NH2 | — | CH | — | C | — | N | — | CH | — | C | — | N | — | CH | — | COOH | + |  H2O H2O
| n+2 | NH2 | — | CH | — | COOH | |||
| | | | | | | | | ||||||||||||||||||||||||
| R | R |
| R | R |
4. Лиазы.Ферменты этого класса ускоряют реакции распада по связям С–С; С–N; С–О без участия воды.
а) декарбоксилазы аминокислот:
 СН3-СН-СООН СН3-СН2-NН2 + СО2
СН3-СН-СООН СН3-СН2-NН2 + СО2
| этиламин
NH2 ала
б) декарбоксилазы кетокислот:
 СН3-С-СООН СН3-С=О + СО2
СН3-С-СООН СН3-С=О + СО2
|| уксусный \
О ПВК альдегид Н
в) альдолаза
| CH2—O—P | P | фосфодиоксиацетон | |||||||||||
| | | | | (ФДОА) | |||||||||||
| HO | — | C | 
| O | O | OH | |||||||
| | | | | || | | | ||||||||||
| HO | — | C | — | H | 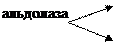
| C | — | C | — | CH2 | |||
| | | 
| ||||||||||||
| H | — | C | — | OH | CH2 | — | CH | — | C | — | H | ||
| | | | | | | || | ||||||||||
| H | — | C | O | OH | O | ||||||||
| | | | | (3-ФГА) | |||||||||||
| CH2—O—P | P | 3-фосфоглицериновый альдегид | |||||||||||
| фруктозо-1,6-дифосфат |
г) аспартат-аммиак-лиаза
СООН СООН
| |
CH-NH2 CH + NH3
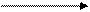 | ||
| ||
CH2 CH
| |
COOH COOH
Аспарагиновая к-та фумарат
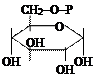
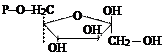
5. Изомеразы. Ускоряют структурные изменения в пределах одной молекулы.
| 
| 
|
| глюкозо-6-фосфат | фруктозо-6-фосфат |
2) Лигазы (синтетазы).Ускоряют реакции синтеза веществ за счёт энергии АТФ.
а) Синтез аспарагина (амида аспарагиновой кислоты)
| NH2 | — | CH | — | COOH | NH2 | — | CH | — | COOH | |||||
| | |
| | | ||||||||||||
| CH2 | + | NH3 |
| CH2 | ||||||||||
| | |

| | | ||||||||||||
| OH | — | C | = | O | NH2 | — | C | = | O | |||||
| аспарагиновая кислота | аспарагин |
б) Синтез глутамина (амида глутаминовой кислоты)
| NH2 | — | CH | — | COOH | 
| NH2 | — | CH | — | COOH | ||
| | | | | |||||||||||
| (CH2)2 | + | NH3 | (CH2)2 | |||||||||
| | | | | |||||||||||
| OH | — | C | = | O | NH2 | — | C | = | O | |||
| глутаминовая кислота | глутамин |
Лекция 7 «Гормоны»
План:
1. Общее представление о гормонах как регуляторах биохимических процессов, образующихся в железах внутренней секреции. Химическая природа гормонов. Гормоны-белки, гормоны-производные аминокислот, стероидные гормоны.
2. Функции важнейших гормонов в организме. Влияние гормонов на биохимические процессы: на изменение активности ферментов, регуляцию белкового синтеза, на проницаемость клеточных мембран. Изменение секреции при мышечной деятельности.
3. Биохимическая сущность антагонизма и синергизма действия гормонов. Гормональные ансамбли, их биологическая роль.
ВОПРОС 1. Гормоны – специфические физиологически активные вещества, вырабатываемые специальными эндокринными органами или тканями, секретируемые в кровь или лимфы и действующие на строение и функции организма вне места своего образования. Гормоны участвуют в регуляции функций организма как единого целого.
Термин «гормон» (от греческого побуждаю, привожу в движение) был предложен У.Бейлиссом и Э Старлингом в 1905 г. Несмотря на разную химическую природу, гормоны имеют общие биологические признаки:
· Дистантность действия – гормоны регулируют обмен и функции эффекторных клеток на расстоянии;
· Строгая специфичность действия – один гормон нельзя заменить другим;
· Высокая биологическая активность – для функционирования организма достаточно очень малых количеств гормонов.
По химической природе гормоны делятся на:
I. Гормоны белковой природы:
1. Поджелудочная железа (островки Лангерганса): инсулин, глюкагон.
2. Гипофиз:
Передняя доля: соматотропный гормон (СТГ),
адренокортикотропный гормон (АКТГ),
тиреотропный гормон (ТТГ),
фолликулостимулирующий гормон (ФСГ),
лютеинизирующий гормон (два последних гормона являются гонадотропными гормонами).
Задняя доля: вазопрессин, окситоцин.
3. Околощитовидные железы: паратгормон.
II. Гормоны, производные аминокислот:
1. Щитовидная железа: тироксин.
2. Надпочечники (мозговое вещество): адреналин, норадреналин.
III. Стероидные гормоны:
1. Надпочечники (кора): глюкокортикоиды (кортикостерон, кортизон, гидрокортизон),
минералокортикоиды (дезоксикортикостерон),
альдостерон,
андрогенные гормоны.
2. Половые железы:
Мужские половые гормоны: андростерон, дегидроандростерон, тестостерон.
Женские половые гормоны: экстрадиол, эстрон, эстриол.
IV. Тканевые гормоны (гормоноподобные вещества):
1. Двенадцатиперстная кишка: секретин.
2. Желудок: гастрин.
3. Кишечник: панкреозимин.
4. Гистамин, серотонин.
ВОПРОС 2.
Дата добавления: 2016-01-26; просмотров: 1604;
