Каталитические процессы и реакторы
Применение катализаторов позволяет ускорять химические реакции в тысячи и даже в миллионы раз, поэтому катализ очень распространен в различных отраслях химической промышленности. Около 70% химических производств включают каталитические стадии. Ряд промышленных процессов удалось осуществить только благодаря применению катализаторов, в частности, к ним относятся крупномасштабные производства аммиака, азотной и серной кислот, синтетического каучука. Разнообразно применение катализа в органических синтезах для ускорения реакций окисления, гидрирования, дегидрирования, гидратации и др. С помощью катализаторов получают основные полупродукты для синтеза полимеров. Громадное значение в обеспечении авто- и авиатранспорта моторными топливами имеют процессы каталитического крекинга и риформинга нефтепродуктов.
СУЩНОСТЬ И ВИДЫ КАТАЛИЗА
Катализом называется увеличение скорости химических реакций или возбуждение их при воздействии веществ-катализаторов, которые участвуют в реакции, вступая в промежуточное химическое взаимодействие с реагентами, но восстанавливают свой химический состав с окончанием акта катализа.
Некоторое представление о каталитических процессах, применяемых в промышленности, дает табл. 1 (см. Приложение).
По принципу фазового состояния реагентов и катализатора каталитические процессы разделяют на две основные группы: гомогенные и гетерогенные.
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе — газовой или жидкой. При гетерогенном катализе катализатор и реагенты или продукты реакции находятся в разных фазах; обычно применяют твердые катализаторы.
Переходным от гомогенного к гетерогенному является микрогетерогенный, в том числе ферментативный катализ, при котором катализатор находится в коллоидном состоянии.
Если термодинамически возможны различные параллельные реакции основного исходного вещества, то применение катализатора, ускоряющего одну из возможных реакций, позволяет подавлять остальные и получать такой целевой продукт, который при некаталитической реакции не получается. В ряде процессов применение катализаторов разного действия позволит получить со значительным выходом различные продукты.
При изменении реакционного пути с участием катализатора реакция протекает через ряд элементарных стадий, которые требуют меньшей энергии активации, чем прямая реакция без катализатора.
Практическое поведение промышленных катализаторов связано с основными их технологическими характеристиками: активностью, температурой зажигания, избирательным действием (селективностью), износоустойчивостью, термостойкостью, отравляемостью и т. п. Основной характеристикой катализаторов служит их активность, т. е. мера ускоряющего действия катализатора по отношению к данной реакции.
Все каталитические реакции, происходящие при гомогенном и гетерогенном катализе, делят по типу взаимодействия катализатора с реагирующими веществами на два основных класса: окислительно-восстановительное (гомолитическое) и кислотно-основное (гетеролитическое) взаимодействия.
Общий механизм электронного окислительно-восстановительного катализа заключается в обмене электронами между катализатором и реагентами, который облегчает электронные переходы в реагирующих молекулах. Механизм обычного ионного, кислотно-основного катализа заключается в обмене протонами или ионами (катионами и анионами) между катализатором и реагирующими молекулами. Образующиеся промежуточные активированные комплексы неустойчивы и распадаются или реагируют с другой молекулой. В обоих случаях катализатор регенерируется.
К окислительно-восстановительным относят многочисленные реакции окисления, гидрирования, дегидрирования. Типичными катализаторами для окислительно-восстайовительных реакций служат металлы (Fe, Cu, Ag, Ni, Pt, Pd и др.) и оксиды металлов переменной валентности, в частности Fe2O3, Cr2O3, CuO, V2O5 и др. К кислотно-основным относят реакции: гидратации и дегидратации, гидролиза, полимеризации, поликонденсации, крекинга, изомеризации, алкилирования. Типичные катализаторы кислотно-основных реакций — кислоты и основания, H2SO4, H3PO4, SiO2, A12O3, NaOH и др. Сложные многокомпонентные катализаторы могут одновременно ускорять как окислительно-восстановительные, так и кислотно-основные реакции.
Избирательные (селективные) катализаторы ускоряют одну целевую реакцию из нескольких при многомаршрутных реакциях. Особенно важен такой катализ в производстве органических продуктов, когда селективность катализаторов позволяет сильно ускорять одну полезную реакцию, проводить процесс при пониженной температуре, подавляя другие возможные реакции.
Автокаталитическими называются реакции, в которых катализатором является один из промежуточных или конечных продуктов реакции. Так, в цепных реакциях автокатализаторами служат свободные радикалы. К числу автокаталитических относятся некоторые реакции разложения взрывчатых веществ, горения, полимеризации и др.
Для автокатализа характерна малая скорость реакций в начальный период, называемый периодом индукции, и быстрое нарастание выхода продукта в последующий период в результате возрастания количества катализатора. В дальнейшем выход продукта увеличивается согласно закону действующих масс, так же как и для обычных реакций.
Для возбуждения цепных реакций в исходную смесь обычно вносится вещество — инициатор, которое, реагируя с исходным веществом, вызывает зарождение цепи, т. е. образование первых свободных радикалов, и таким образом ускоряет реакцию подобно катализатору. Однако инициаторы в отличие от типичных катализаторов расходуются в процессе реакции.
ГОМОГЕННЫЙ И ГЕТЕРОГЕННЫЙ КАТАЛИЗ
Гомогенный катализ. Такой катализ может протекать в газовой или жидкой фазе. Механизм гомогенного катализа состоит в образовании между реагентами и катализаторами нестойких, промежуточных соединений, существующих в той же фазе (газовой или жидкой), после распада которых образуется продукт реакции, а катализатор регенерируется. Процессы гомогенного катализа классифицируются по типу взаимодействия между реагирующими веществами и катализатором на окислительно-восстановительное и кислотно-основное взаимодействие. По фазовому состоянию гомогенные каталитические процессы делят на жидкофазные (в растворах) и газофазные.
Катализаторами в растворах служат кислоты (катион Н+), основания (анион ОН–), ионы металлов (Ме+, Ме2+), а
также вещества, способствующие образованию свободных радикалов.
Механизм кислотно-основного (ионного) катализа в растворах заключается в том, что идет обмен протонами между катализатором и реагирующими веществами, сопровождающийся внутримолекулярными превращениями. При кислотном катализе протон (или положительный ион) переходит сначала от катализатора к реагирующей молекуле, а при основном катализе катализатор служит вначале акцептором протона или донором аниона по отношению к молекуле реагента. В последующей стадии каталитической реакции протон перемещается в обратном направлении и катализатор восстанавливает свой состав.
По такому типу протекают реакции гидратации, дегидратации, гидролиза, этерификации, поликонденсации в растворах. Примером кислотно-основного катализа в растворе может служить гидратация олефинов в спирты, катализируемая кислотами (НА).
 К ионным относятся и окислительно-восстановительные каталитические реакции в растворах, ускоряемые ионами металлов с переменной степенью окисления: меди, марганца, железа.
К ионным относятся и окислительно-восстановительные каталитические реакции в растворах, ускоряемые ионами металлов с переменной степенью окисления: меди, марганца, железа.
Газофазный гомогенный катализ, т. е. процесс, при
котором и реагенты и катализатор — газы, применяют сравнительно редко. Примером его могут служить дегидратация уксусной кислоты в парах при участии катализатора — парообразного
триэтилфосфата, окисление метана в формальдегид кислородом
воздуха, ускоряемое оксидами азота.
Газофазный катализ может осуществляться по молекулярному
и радикальному цепному механизму.
При молекулярном механизме каталитической реакции происходит обмен атомами между катализатором и реагирующими веществами. /
Радикальный механизм гомогенного катализа возможен
как в газовой, так и в жидкой фазе. Катализатор служит инициатором, направляющим реакцию по цепному механизму. Ускорение
достигается в результате появления богатых энергией частиц —
свободных радикалов в процессе самой реакции. По такому механизму протекают некоторые окислительные реакции в газах, полимеризация в жидкой фазе и т. п.
Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной продукционной смеси (жидкости или газа), в результате чего часть катализатора теряется безвозвратно, а продукт загрязняется им. При гетерогенном катализе газовая или жидкая реакционная смесь легко отделяется от твердого катализатора.
Гетерогенный катализ. Этот вид катализа широко применяется в промышленности. Подавляющее большинство известных промышленных гетерогенных каталитических процессов основано на реакциях между газообразными веществами с участием твердых катализаторов, хотя известны и другие сочетания по фазовому состоянию между реагирующими веществами и катализатором.
Существует несколько различных теорий, объясняющих процесс катализа. Каждая из этих теорий, дополняя и развивая друг друга, объясняет ускоряющее действие твердых катализаторов. Из большинства теоретических положений видно, что важную роль для катализа играют активные центры, т. е. неоднородные участки поверхности, обладающие повышенной активностью. Общим для всех теорий катализа является образование на поверхности твердого катализатора промежуточного соединения адсорбционного типа, которое не образует отдельных фаз и не обнаруживается чисто химическим анализом. Строение этого соединения представляют в разных гипотезах различно: в виде активного комплекса или активного ансамбля, определенного геометрического образования — мультиплета или химического соединения с участием свободных электронов катализатора. Свойства промежуточного соединения определяют направление, а если процесс протекает в кинетической области, то скорость реакции.
Для цепных реакций катализ имеет обычно гетерогенно-гомогенный характер, т. е. на поверхности катализатора возникает радикал (гетерогенная стадия), который и возбуждает цепную реакцию в объеме газа или жидкости (гомогенная стадия).
Твердые катализаторы готовят и применяют, как правило, в виде небольших пористых зерен, таблеток, гранул. При этом внутренняя поверхность стенок пор может в сотни и тысячи раз превосходить внешнею поверхность зерна.
Каталитическая активность твердых пористых катализаторов определяется как их химическим составом, так и пористой структурой, при которой подразумевают совокупность формы зерен, объема и размера пор и внутренней поверхности зерна. Активность катализатора пропорциональна поверхности, доступной для реагентов, но в тонкопористых катализаторах внутренняя поверхность может быть использована далеко не полностью из-за диффузионных торможений.
Процесс катализа на твердых пористых катализаторах состоит из следующих элементарных стадий: 1) диффузии реагирующих веществ из ядра потока к поверхности зерен катализатора; 2) диффузии реагентов в порах зерна катализатора; 3) активированной адсорбции (хемосорбция) на поверхности катализатора с образованием поверхностных химических соединений — активированных комплексов: реагенты — катализатор; 4) перегруппировки атомов с образованием поверхностных комплексов: продукт — катализатор; 5) десорбции продукта с поверхности; 6) диффузии продуктов в порах зерна катализатора; 7) диффузии продукта от поверхности зерна катализатора в ядро потока.
В зависимости от определяющей стадии различают каталитические процессы, происходящие в кинетической, внешне-диффузионной и внутридиффузионной областях. В кинетической области константа скорости процесса не зависит от коэффициентов диффузии.
Возможны две физические модели механизма каталитического
превращения (синтеза).
1. Адсорбируются оба реагента (А и В) и затем происходит взаимодействие их на катализаторе (К) с последующей десорбцией.
Графически примерное изменение энергетического состояния системы по стадиям реакции представлено на рис. 1.
|
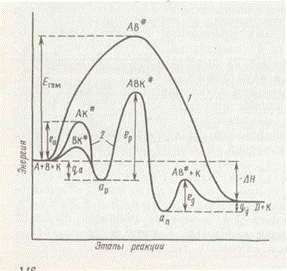
2. Адсорбируется один реагент, например А, затем он реагирует с налетающими из газовой (жидкой) среды молекулами второго реагента В. Так происходит синтез аммиака: адсорбируется азот, налетают и реагируют с ним молекулы водорода.
Выход продукта эндотермической реакции непрерывно увеличивается с повышением температуры. Типичным примером эндотермической реакции может служить взаимодействие метана с водяным паром на никелевом катализаторе:
СН4 + Н2О = СО + 3Н2
| \ |
Зависимость степени превращения (х) метана от температуры и концентрации реагентов приведена на рис. 2.
| |
| |
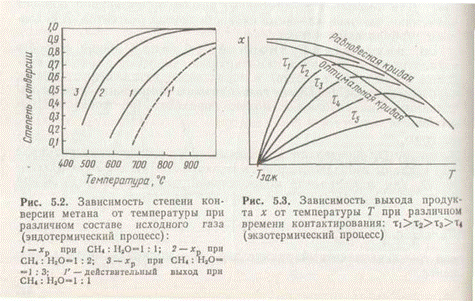
Степень превращения, т. е. выход водорода и СО, растет с повышением температуры. При стехиометрическом расходе водяного пара (кривая 1) практически полное превращение метана может быть достигнуто в состоянии равновесия лишь при температурах выше 900°С. Увеличение концентрации водяного пара позволяет сдвинуть равновесие реакции вправо при более низких температурах (кривые 2 и 3). Аналогично увеличению концентрации действует и повышение давления. Действительный выход продукта х в эндотермических эоцессах изменяется подобно равновесному.
Для обратимых экзотермических реакций с повышением температуры равновесный выход продукта непрерывно уменьшается, а действительный выход увеличивается при низких температурах и уменьшается при высоких, проходя через максимум при оптимальной температуре (рис. 3).
На рис. 4 показана зависимость х от Т при постоянном х для катализаторов разной активности: А1>А2>А3>А4, обладающих соответственно разной температурой зажигания.
| |
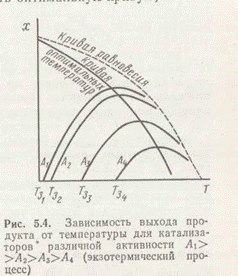
акций, в частности для промышленных каталитических процессов: гидрирования, окисления, гидратации и др. Кривые рис. 3 и 4 типичны для реакций синтеза аммиака, каталитического окисления SO2, конверсии оксида углерода, окисления этилена в оксид этилена, синтеза углеводородов гидрированием СО и многих других процессов.
Время контактирования (соприкосновения) реагирующих веществ с катализатором — важная технологическая характеристика каталитического процесса, которая позволяет производить расчет реакционных аппаратов.
Отравление катализатора — это частичная или полная потеря активности в результате действия небольшого количества веществ, называемых контактными ядами. Контактные яды обычно поступают в виде примесей к исходным реагентам (газам, жидкостям). Потеря активности происходит вследствие частичного или полного выключения активной поверхности катализатора. Механизм отравления специфичен для данного яда и катализатора и многообразен. Оно наступает в результате химического взаимодействия яда с катализатором с образованием каталитически неактивного соединения, активированной адсорбции яда на активных центрах катализатора, кристаллизации яда или его производного на поверхности катализатора.
Отравление может быть обратимым и необратимым. При обратимом отравлении активность катализатора снижается лишь во время присутствия ядов в поступающей смеси. При поступлении чистой смеси соединения яда с катализатором разлагаются, адсорбированный яд улетучивается и отгоняется вместе с продуктами реакции. Необратимое отравление является постоянным; отравленный катализатор выгружают из аппарата и заменяют новыми или же регенерируют экстракцией яда или катализатора из контактной массы.
Наиболее чувствительны к ядам металлические катализаторы, особенно из благородных металлов. Оксидные катализаторы менее чувствительны к ядам.
Помимо отравления активность катализатора может падать, во-первых, вследствие уменьшения активной поверхности при повышенных температурах, из-за рекристаллизации, спекания, оплавления кристаллов; во-вторых, при механическом экранировании поверхности катализатора примесями, например пылью (в газе) или твердыми веществами, образующимися при катализе.
СВОЙСТВА ТВЕРДЫХ КАТАЛИЗАТОРОВ И ИХ ПРИГОТОВЛЕНИЕ
Промышленные твердые катализаторы обычно не являются индивидуальными веществами. Они представляют собой, как правило, сложную смесь, которая называется контактной массой. В контактной массе одни вещества являются собственно катализаторами, а другие служат активаторами (модификаторами) и носителями.
Активаторами, или промоторами, называют вещества, повышающие активность основного катализатора. Активация может происходить вследствие химического взаимодействия добавок с каталитическим веществом с образованием продуктов, обладающих повышенной каталитической активностью. Добавки могут образовывать с катализатором твердые растворы с электронной структурой, соответствующей большей каталитической активности. Иногда активатор увеличивает поверхность каталитически активного вещества или повышает термостойкость катализатора, а иногда служит защитой основного катализатора от действия контактных ядов.
Носителями, или трегерами, называют термостойкие, прочные, пористые вещества, на которые осаждением из раствора или другим способом наносят катализатор. Нанесение каталитических веществ на пористый носитель обеспечивает их тонкое диспергирование, создает большую удельную поверхность при оптимальных размерах пор и повышает термостойкость катализатора, так как затруднено спекание его кристаллов, разобщенных на поверхности носителя. Кроме того, достигается экономия дорогих каталитических веществ, таких, как платина, палладий, серебро и др. Носитель обычно влияет и на активность катализатора, действуя как активатор. В качестве носителя чаще всего применяют оксид алюминия, силикагель, синтетические алюмосиликаты, каолин, асбест, различные соли, активный уголь.
К промышленным катализаторам предъявляются следующие основные требования: достаточно высокая активность, стойкость к действию контактных ядов, избирательность, стабильность в работе, достаточная теплопроводность, термостойкость, механическая прочность, малая стоимость. К катализаторам реакторов кипящего слоя предъявляется дополнительное требование — высокая износоустойчивость зерен при ударах и трении друг о друга, о стенки реактора и теплообменных устройств.
Основные методы приготовления катализаторов. Существует несколько приемов (методов) приготовления катализаторов.
1. Осаждение гидроксидов или карбонатов из растворов их солей совместно с носителем или без носителя с последующим формованием и прокаливанием контактной массы (осажденные катализаторы). Так, катализаторы кислотно-основных реакций готовят соосаждением компонентов, например совместной коагуляцией гелей (алюмосиликаты, силикагель).
2. Смешение и совместное прессование порошков с получением
смешанных катализаторов или катализаторов с активаторами и
носителями, а также с вяжущими веществами.
3. Сплавление нескольких веществ (металлов или оксидов) с
последующим восстановлением металлов из оксидов водородом
(например, железный катализатор синтеза аммиака) или другими газами, иногда с последующим выщелачиванием одного из
металлов. Так, скелетный никелевый катализатор гидрирования
изготовляют сплавлением никеля с алюминием с последующим
выщелачиванием последнего. Иногда катализатор готовят в виде
тончайших сеток из сплавов различных металлов (платино-палладиево-родиевые сетки для окисления аммиака).
4. Пропитка пористого носителя раствором, содержащим катализатор и активатор, с последующей сушкой и прокалкой. К катализаторам данного вида относятся металлические, оксидные, солевые, кислотные и основные.
В качестве катализаторов применяют также некоторые минералы и смеси их, например алюмосиликаты, оксиды железа, бокситы и т. п.
КАТАЛИТИЧЕСКИЕ РЕАКТОРЫ
Основные положения о химических реакторах, рассмотренные в лекции 3, относятся и к каталитическим реакторам.
Однако в устройстве и работе каталитических реакторов имеются особенности, вызванные необходимостью обеспечения действия катализатора в оптимальных для него условиях.
Реакторы гомогенного катализа. Они имеют сравнительно простое устройство, мало отличающееся от некаталитических реакторов. Жидкофазные реакторы с катализатором, растворенным в жидкости, обычно являются смесителями с механическими мешалками, пневматическим или струйным перемешиванием. Для жидкофазного гомогенного катализа (катализатор растворен в жидкости) в системе газ — жидкость применяют колонны с насадкой или барботажные аппараты. Газофазные каталитические экзотермические процессы можно осуществлять в пустотелых камерах со смешением исходных реагентов в соплах на входе в аппарат. Газофазные эндотермические процессы осуществляют в реакторах типа кожухотрубных теплообменников, в трубах которых происходит катализ, а в межтрубном пространстве проходит горячий топочный газ. Так, в частности, осуществляется дегидратация паров уксусной кислоты с газообразным триэтилфосфатом в качестве катализатора.
Реакторы гетерогенного катализа. Реакторы, работающие на твердых катализаторах, применяют для газо- и жидкофазных процессов. Большинство промышленных каталитических процессов осуществляют в газообразной среде в контактных аппаратах на твердых катализаторах.
По гидродинамическому режиму взаимодействия зернистого твердого катализатора с потоком газа каталитические реакторы делят на следующие группы: 1) с неподвижным (фильтрующим) слоем катализатора; 2) со взвешенным (кипящим) слоем катализатора; 3) с непрерывно движущимся катализатором по всей высоте реакционного объема. Этой классификацией не охвачены реакторы поверхностного контакта с размещением катализатора в виде труб или сеток, через которые пропускается газ.
Контактные аппараты поверхностного контакта применяют реже, чем аппараты с фильтрующим или взвешенным слоем катализатора. Аппараты такого типа целесообразно применять лишь для быстрых экзотермических реакций на высокоактивном катализаторе, обеспечивающем выход, близкий к теоретическому. Время соприкосновения газа с поверхностью сеток составляет тысячные — десятитысячные доли секунды. Такие аппараты просты по устройству и высокопроизводительны. Их используют для окисления аммиака на платино-палладиево-родиевых сетках, для синтеза ацетона из изопропилового спирта на серебряных сетках. Эти же процессы с применением других менее активных, но более дешевых катализаторов проводят в аппаратах с фильтрующим или взвешенным слоем катализатора. В некоторых случаях, чтобы совместить катализ и нагрев газовой смеси, катализатор наносят на стенки теплообменных труб.
Аппараты с фильтрующим слоем катализатора в настоящее время наиболее распространены. Они применимы для любого типа каталитических реакций. В этих аппаратах слой или несколько слоев катализатора неподвижно лежат на решетчатых опорах (полках) или загружены в трубы и через неподвижный катализатор пропускается смесь реагирующих газов при режиме, близком к идеальному вытеснению.
Катализатор имеет форму зерен, таблеток или гранул различных размеров, но, как правило, не менее 4—5 мм в поперечнике, так как при более мелких частицах резко возрастает гидравлическое сопротивление слоя катализатора и легче происходит его спекание. Количество загруженного катализатора, высота, число слоев и расположение их в аппарате зависят от активности катализатора, характера каталитической реакции, условий теплообмена.
Аппаратурное оформление контактных аппаратов фильтрующего слоя с теплообменниками весьма разнообразно. Наиболее широко в промышленности применяют следующие типы: 1) аппараты без теплообменников (когда это возможно); 2) системы (агрегаты) контактных аппаратов с внешними теплообменниками; 3) полочные контактные аппараты ступенчатого отвода теплоты: а) с теплообменниками между полками, б) с охлаждением между полками введением холодных реагентов; 4) трубчатые аппараты непрерывного отвода теплоты: а) с размещением катализатора в трубах, б) в межтрубном пространстве. В отдельных типах аппаратов комбинируются полочные и трубчатые ступени или же совмещается отвод теплоты в теплообменниках с охлаждением газа введением холодных реагентов между полками.
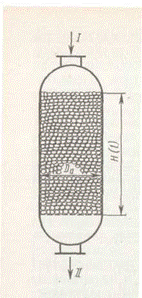 Аппараты с фильтрующим слоем без теплообменных устройств наиболее просты по конструкции (рис. 5).
Аппараты с фильтрующим слоем без теплообменных устройств наиболее просты по конструкции (рис. 5).
Они работают на адиабатическом тепловом режиме, причем температурный режим регулируется только изменением состава и температуры исходного газа. Такие аппараты можно применять: а) для практически необратимых экзотермических реакций; б) для реакций с низкой концентрацией реагентов, например при каталитической очистке газов окислением или гидрированием примесей; в) для экзотермических реакций с небольшим тепловым эффектом.
| |
 Существует несколько способов теплообмена в контактных аппаратах, причем конструктивные приемы отвода теплоты из реакционного объема и подведения теплоты однотипны для проведения экзотермических и эндотермических реакций.
Существует несколько способов теплообмена в контактных аппаратах, причем конструктивные приемы отвода теплоты из реакционного объема и подведения теплоты однотипны для проведения экзотермических и эндотермических реакций.
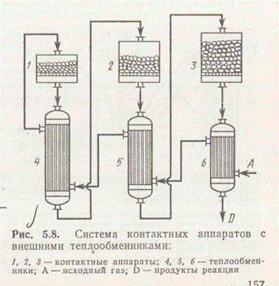
 В контактных аппаратах с внешними теплообменниками теплообмен производится между стадиями контактирования для поддержания температурного режима, близкого к оптимальному. На рис. 6 приведена принципиальная схема. Такая схема характерна для обратимых экзотермических реакций. Свежий газ нагревается в теплообменнике 6 за счет теплоты продуктов реакции, прошедших контактирование, и затем последовательно проходит межтрубное пространство теплообменников 5 и 4, подогреваясь до температуры начала каталитической реакции (температуры зажигания t3). Затем газ последовательно проходит через слои катализатора в контактных аппаратах и внутри труб соответствующих теплообменников.
В контактных аппаратах с внешними теплообменниками теплообмен производится между стадиями контактирования для поддержания температурного режима, близкого к оптимальному. На рис. 6 приведена принципиальная схема. Такая схема характерна для обратимых экзотермических реакций. Свежий газ нагревается в теплообменнике 6 за счет теплоты продуктов реакции, прошедших контактирование, и затем последовательно проходит межтрубное пространство теплообменников 5 и 4, подогреваясь до температуры начала каталитической реакции (температуры зажигания t3). Затем газ последовательно проходит через слои катализатора в контактных аппаратах и внутри труб соответствующих теплообменников.
| |
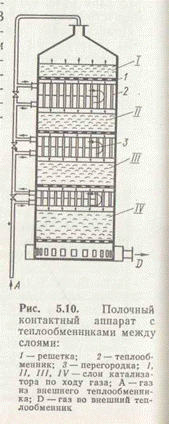
Между дырчатыми полками, на которых расположены слои катализатора, размещены теплообменники. В межтрубном пространстве теплообменников последовательно проходит свежий газ, охлаждая продукты реакции и нагреваясь до температуры начала реакции.
В трубчатых контактных а п п а р а т а х теплообмен происходит непрерывно и одновременно с каталитической реакцией. Катализ происходит при политермическом режиме; тепловой эффект реакции частично компенсируется подводом или отводом теплоты. Примером контактного аппарата с двойными теплообменными трубками может служить один из типов колонны синтеза аммиака при среднем давлении.
В технологии широко используются аппараты со взвешенным (кипящим, псевдоожиженным) слоем катализатора. В кипящем слое применяют мелкозернистый катализатор обычно с размерами зерен от 0,05 до 3,0 мм. Исходные газы поступают в аппарат снизу вверх. Поток газа уравновешивает силу тяжести частиц катализатора, поэтому они находятся в постоянном контакте с молекулами газа. Теплопроводность кипящего слоя в тысячи раз выше неподвижного слоя катализатора. В результате слой изотермичен по высоте и сечению. В аппаратах такого типа эффективна работа водяных теплобменников, которые используются для получения товарного пара.
Главным недостатком взвешенного слоя по сравнению с неподвижным является снижение движущей силы процесса вследствие более полного перемешивания газа, а также из-за прохождения части газа через слой в виде крупных пузырей. Применение многослойных аппаратов позволяет сблизить движущую силу процесса в аппаратах со взвешенным и неподвижным катализатором и одновременно приблизить температурный режим к оптимальному. Для некоторого снижения степени перемешивания и разбивания крупных пузырей помещают во взвешенном слое насадки различных видов. Однако это усложняет конструкцию реактора. Другой недостаток — истирание зерен катализатора, особенно острых углов и ребер. Для взвешенного слоя необходимы высокопрочные, износоустойчивые, мелкозернистые контактные массы, те же контактные массы, которые используют в неподвижном слое, как правило, не применимы.
Реакторы с движущимся катализатором применяют для парофазного крекинга нефтепродуктов, но могут использоваться и в других процессах катализа, где требуется непрерывная циркуляция катализатора между реактором и регенератором. Здесь они успешно конкурируют с реакторами взвешенного слоя. Применяют контактные аппараты с движущимся катализатором двух типов: а) со взвесью мелкозернистого катализатора впотоке газа (восходящий поток); б) с плотным слоем крупнозернистого катализатора, опускающегося в шахтном аппарате сверху вниз в прямотоке или противотоке с реагирующими газами
Недостатком установок с восходящим потоком катализаторов является трудность полного отделения пылевидного катализатора отгазового потока. В этих установках много места занимают уловители катализаторной пыли: циклоны, электрофильтры.
Ферментативные биохимические процессы.Ферментативные процессы также относятся к каталитическим, поскольку протекают под действием природных катализаторов.
Биохимические процессы весьма перспективны для химической технологии. Они происходят в живой природе в атмосферных условиях (без повышения температуры, давления) под действием высокоактивных природных катализаторов — ферментов и гормонов, а также микроорганизмов, содержащих эти катализаторы. Возможности биохимических процессов в промышленности не ограничены, хотя природные биохимические процессы пока недостаточно изучены и еще мало воспроизведены в модельных условиях.
| <== предыдущая лекция | | | следующая лекция ==> |
| Некаталитические процессы и реакторы | | | Сырьевые проблемы химической промышленности |
Дата добавления: 2016-01-20; просмотров: 64777;
