Нарушения сердечного ритма и проводимости (с указанием формы). 16 страница
Помимо активаторов фибринолиза существуют и ингибиторы превращения плазминогена в плазмин, к которым относятся быстродействующий a2-антиплазмин, антитрипсин, a2-макроглобулин, Cl-эстеразный ингибитор и др. Мощным ингибитором фибринолиза является синтетическая e-аминокапроновая кислота.
Все препараты, используемые в настоящее время для тромболизиса у больных ИМ, относятся к активаторам эндогенного плазминогена. К наиболее распространенным из них относятся:
Стрептокиназа — непрямой активатор плазминогена, получаемый из культуры b-гемолитического стрептококка группы С. Стрептокиназа образует в крови ковалентную связь с плазминогеном, активируя его превращение в плазмин. В связи с этим стрептокиназа, помимо воздействия на фибрин тромба, оказывает также выраженное системное фибринолитическое действие.
Урокиназа — фермент, непосредственно активирующий превращение плазминогена в плазмин. Препарат получают из культуры почек человеческого эмбриона.
Алтеплаза— представляет собой тканевой активатор плазминогена (ТАП), который продуцируется, в основном, эндотелиальными клетками сосудов. Активация ТАП в сосудистом русле происходит под действием плазмина, трипсина, калликреина или активированного фактора Х свертывающей системы крови. Тканевой активатор плазминогена, в отличие от стрептокиназы, обладает сродством к фибрину, поэтому он избирательно действует в области фибринного тромба, проявляя свойства фибриноселективности или фибриноспецифичности. Это положительное свойство алтеплазы объясняет высокую эффективность препарата. Следует все же иметь в виду, что при использовании доз, необходимых для лизиса тромба, алтеплаза воздействует и на циркулирующий в крови плазминоген, оказывая также системное действие на фибринолиз, хотя и менее выраженное, чем стрептокиназа. Это приводит к снижению уровня фибриногена в сыворотке крови и повышению риска кровотечений (основного осложнения тромболитической терапии).
Показания
Ранняя реперфузия миокарда, проведенная в пределах 6 ч от начала заболевания, существенно увеличивает выживаемость больных ИМ (рис. 6.41). Принимая решение о целесообразности проведения тромболизиса, всегда следует оценить возможную пользу и риск от тромболитической терапии. Ясно, что максимальный положительный эффект может быть достигнут у пациентов с высоким риском летального исхода при “естественном” течении ИМ (без тромболизиса). К числу таких больных относятся:
- пациенты с передним трансмуральным ИМ, если имеется значительный подъем сегмента RS–Т в грудных отведениях;
- пациенты с нижним трансмуральным ИМ, если имеется значительный подъем RS–Т в отведениях III, aVF, II в сочетании с реципрокной депрессией сегмента RS–Т в грудных отведениях;
- пациенты с острым ИМ и “новой” блокадой левой ножки пучка Гиса.
Кроме того, несколько клинических ситуаций увеличивают риск летального исхода при “естественном” течении ИМ и, следовательно, делают целесообразным проведение срочной тромболитической терапии (G.J. Taylor, 2001):
- прогрессирующая сердечная недостаточность с признаками застоя в легких;
- отек легких;
- кардиогенный шок;
- перенесенный ранее ИМ;
- ИМ правого желудочка;
- наличие сопутствующего сахарного диабета и др.
| Рис. 6.41. Динамика общего количества сосудистых смертей у пациентов с острым нфарктом миокарда в зависимости от применения стрептокиназы, аспирина,их сочетания или плацебо (результаты исследования ISIS-2). В скобках указан процент летального исхода к 35-му дню инфаркта миокарда | 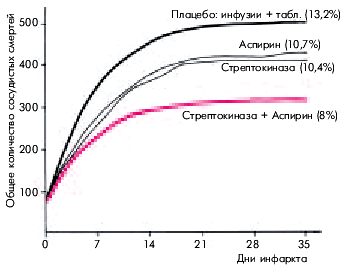
|
Учитывая необходимость наиболее раннего принятия решения о целесообразности реперфузионной терапии, основанием для такого решения в большинстве случаев являются клинические данные, а также выраженный подъем сегмента RS–Т на ЭКГ, зарегистрированной у вновь поступившего больного с болями в сердце. Как правило, в этот момент еще отсутствует патологический зубец Q. В этих случаях не следует дожидаться лабораторного подтверждения диагноза ИМ или появления патологического зубца Q на ЭКГ, поскольку это ведет к непростительной потере времени и быстро уменьшает шансы положительного эффекта реперфузионной терапии.
С другой стороны, появление на ЭКГ у вновь поступившего больного с острым коронарным синдромом и стойким подъемом сегмента RS–Т патологического зубца Q, еще не означает, что произошел некроз сердечной мышцы и тромболизис не показан. В некоторых случаях раннее появление на ЭКГ патологического зубца Q у больного с распространенной ишемией может свидетельствовать лишь о резком падении электрической активности ишемизированного участка сердечной мышцы, обусловленном, например, наличием в этой области гибернирующего миокарда, который тем не менее сохранил свою жизнеспособность.
Противопоказания
В табл. 6.8 перечислены абсолютные и относительные противопоказания к назначению тромболитической терапии.
Таблица 6.8
Абсолютные и относительные противопоказания к проведению тромболитической терапии (по G.J. Taylor, 2001, в модификации)
| Абсолютные противопоказания |
| Продолжающееся внутреннее кровотечение |
| Мозговой инсульт в анамнезе |
| Недавняя (менее 2-х мес назад) внутричерепная или внутриспинальная травма или хирургическое вмешательство |
| Внутричерепная опухоль,артериовенозные шунты или аневризма |
| Определенный геморрагический диатез |
| Тяжелая неконтролируемая АГ |
| Относительные противопоказания |
| Недавнее (не более 10 дней назад) “большое” хирургическое вмешательство (аорто-коронарное шунтирование, акушерское пособие, биопсия органов и др.) |
| Церебрососудистая болезнь головного мозга |
| Недавнее желудочно-кишечное кровотечение или генитально-урологическое кровотечение (менее 10 дней назад) |
| Недавняя травма (менее 10 дней назад) |
| Артериальная гипертензия: систолическое АД не менее 180 мм рт. ст. и/или диастолическое АД не менее 110 мм рт. ст. |
| Высокая вероятность наличия тромбоза левых полостей сердца (например, стеноз левого атриовентрикулярного отверстия или наличие мерцательной аритмии) |
| Острый перикардит |
| Подострый инфекционный эндокардит |
| Дефекты системы гемостаза, включая те из них, которые связаны с тяжелой дисфункцией печени или почек |
| Выраженная печеночная недостаточность |
| Беременность |
| Диабетическая геморрагическая ретинопатия или иные геморрагические офтальмологические состояния |
| Септический тромбофлебит или тромбированный атриовентрикулярный катетер в области с высоким риском инфицирования |
| Возраст старше 75 лет |
| Продолжающаяся пероральная терапия антикоагулянтами (например, варфарином) |
| Любое другое состояние, при котором кровотечение представляет собой серьезную угрозу или может стать особенно сложным для диагностики и лечения по причине локализации своего источника |
Следует иметь в виду, что многие из перечисленных в таблице противопоказаний не являются абсолютными и допускают взвешенный разумный подход к индивидуальной оценке всех положительных и отрицательных последствий тромболитической терапии. Например, у больного с высоким риском летального исхода и наличием одного из относительных противопоказаний тромболитическая терапия вовсе не исключается полностью. Если польза от такой терапии все же превышает риск развития кровотечения или кровоизлияния в мозг (который, естественно, увеличивается при наличии относительного противопоказания), то в ряде случаев целесообразно использовать имеющийся шанс спасти больного.
Методика тромболизиса
Тромболизис проводится не позже чем через 12 ч от начала заболевания.
Стрептокиназу вводят внутривенно капельно в дозе 1,5 млн ЕД в 100 мл 0,9% раствора натрия хлорида в течение 30–60 мин. Стрептокиназа — хорошо изученный и относительно недорогой препарат. Отличается сравнительно низким риском кровоизлияния в мозг и реокклюзии. Однако при применении стрептокиназы отмечается более медленный и менее полный лизис тромба. Введение стрептокиназы иногда сопровождается артериальной гипотензией и аллергическими реакциями. Последние объясняются, вероятно, высокой частотой стрептококковой иммунизации человека и наличием почти у каждого пациента антител к стрептококковым антигенам (напомним, что стрептокиназу получают из культуры b-гемолитического стрептококка). Именно в связи со своей высокой аллергенностью стрептокиназа повторно может вводиться больному не раньше чем через 6 месяев после первого введения.
Алтеплазаотличается более высокой эффективностью тромболизиса, что связано, вероятно, с более быстрым и полным тромболизисом, не вызывает аллергических реакций и снижения АД, но ее применение чаще сопровождается кровоизлиянием в мозг и ассоциируется с повышенным риском реокклюзии КА (в 1,5–2 раза более высоким, чем при применении стрептокиназы). Алтеплазу вводят внутривенно болюсно в дозе 15 мг, после чего продолжают внутривенную инфузию препарата, вначале (в течение 30 мин) в дозе 0,75 мг на 1 кг массы тела, а затем (в течение еще 60 мин) в дозе 0,5 мг на 1 кг массы тела. Возможны и другие варианты внутривенного введения алтеплазы.
Урокиназа. Эффективность этого препарата не отличается от таковой при применении стрептокиназы. Урокиназа отличается также относительно низким риском реокклюзии и кровоизлияний в мозг. Урокиназу применяют в дозе 2 млн ЕД внутривенно болюсно. Возможно первоначальное внутривенное болюсное введение 1,5 млн ЕД с последующим внутривенным капельным введением препарата в течение 1 ч в дозе еще 1,5 млн ЕД.
Следует отметить, что стоимость двух последних тромболитиков, особенно алтеплазы, несравненно выше, чем стрептокиназы.
Критериями эффективности тромболитической терапии являются:
- данные КАГ, проведенной после завершения процедуры тромболизиса;
- быстрое снижение сегмента RS–Т;
- значительный и скачкообразный подъем уровня МВ КФК в сыворотке крови, связанный с эффективной реканализацией КА и вымыванием ферментов в общий кровоток;
- исчезновение ангинозной боли, если она сохранялась в момент начала тромболитической терапии.
Осложнения реперфузионной терапии
При назначении больным острым коронарным синдромом со стойким подъемом сегмента RS–Т реперфузионной терапии всегда следует иметь в виду ее возможные осложнения.
Кровотечения, в том числе геморрагические инсульты, встречаются примерно в 0,5–1,0% случаев. Риск мозгового геморрагического инсульта повышен у лиц пожилого и старческого возраста. Так, в возрасте до 65 лет геморрагии при проведении тромболизиса встречаются в 0,8% случаев, в возрасте старше 65 лет — в 2,1% и в возрасте 75–84 года — у 3,4% больных. Геморрагии в целом несколько чаще возникают при применении препаратов ТАП (алтеплазы) и реже — при использовании стрептокиназы. Кровотечения связывают с системным действием тромболитиков на циркулирующий плазминоген.
При возникновении кровотечений с осторожностью назначают ингибиторы фибринолиза:
- ε-аминокапроновая кислота — 5% раствор внутривенно капельно 100 мл в течение 30 мин. Инфузия может быть продолжена со скоростью 1 г/ч вплоть до остановки кровотечения;
- трасилол (контрикал) — внутривенно капельно по 300 000 МЕ;
- транексамовая кислота (френолиз, экзацил) внутривенно капельно по 1–1,5 г до 3 раз в день.
Гемостатический эффект может быть получен также при переливании свежезамороженной плазмы. Следует помнить, что проведение гемостатической терапии у больного ИМ требует особой осторожности, так как может спровоцировать повторное тромбообразование.
Реперфузионное повреждение миокарда. В ряде экспериментальных и клинических исследований показано, что быстрое восстановление коронарного кровотока в некоторых случаях приводит к дополнительному реперфузионному повреждению сердечной мышцы в виде формирования зоны так называемого “оглушенного” миокарда (stunning). Последний, хотя и сохраняет свою жизнеспособность, отличается резко сниженной сократимостью, восстановление которой происходит очень медленно, в течение нескольких недель.
Феномен “отсутствия кровотока”. Этот феномен выявляется иногда при коронароангиографии, проведенной вскоре после реканализации магистральной артерии, когда, несмотря на восстановленную проходимость крупной КА, на ангиограммах определяется резкое замедление дистального кровотока. На КАГ при этом заметно очень медленное вымывание контрастного вещества из реканализованной артерии и области ИМ. Феномен “отсутствия кровотока” объясняют плохо обратимым поражением микрососудов, проявляющимся выраженным нарушением эндотелиальной функции и потерей микрососудами способности к вазодилатации.
Реперфузионные аритмии. Быстрое восстановление коронарного кровотока иногда сопровождается развитием ускоренного идиовентрикулярного ритма, в основе которого лежит патологический автоматизм эктопического очага. В большинстве случаев этот вид желудочковой аритмии не переходит в ФЖ, поскольку механизм фибрилляции (re-entry) существенно отличается от механизма медленной идиовентрикулярной тахикардии. В некоторых случаях развиваются более серьезные нарушения желудочкового ритма, в том числе ЖТ и ФЖ, лечение которых при ИМ описано ниже.
Повторная окклюзия КА (реокклюзия) после успешного тромболизиса происходит у значительной части больных. Так, по данным исследования Е. Ohman с соавт. (1990), в течение 1 недели после успешного тромболизиса повторная окклюзия наступает в 12,4% случаев. В срок от 48 ч до 3-х месяцев эта цифра достигает 29%. Характерно, что у половины больных реокклюзия КА развивается бессимптомно, без повторной ангинозной боли (Н. White с соавт., 1995). Это объясняется, вероятно, своеобразным “оглушением” болевых рецепторов сердца, возникающим вслед за транзиторной ишемией (G.J. Taylor, 2001). Причиной повторных тромбозов КА после проведения реперфузии является значительная активация тромбоцитов, возникающая в результате лизиса тромба. Поэтому во время проведения процедуры реперфузии и после нее столь важна адекватная антитромбоцитарная и антитромбиновая терапия (см. выше).
Лечение после тромболизиса
Образовавшийся в КА тромб поначалу содержит немного фибрина, на который, собственно, и оказывают влияние фибринолитики, но в его составе много тромбоцитов, продуцирующих, как известно, ингибитор активатора плазминогена-1 (ИАП-1), который угнетает фибринолиз. Это может быть одной из причин того, что после окончания процедуры реперфузии процесс тромбообразования возобновляется с новой силой. Кроме того, когда тромб лизирован, тромбин, также являющийся мощным активатором агрегации тромбоцитов, контактирует с кровью и вновь “запускает” процесс тромбообразования. Иными словами, процедура фибринолиза может сама иметь парадоксальный прокоагулянтный эффект (G.J. Taylor, 2001), который требует соответствующей коррекции. Поэтому после проведения тромболизиса показано обязательное применение современных антитромбоцитарных и антитромбиновых ЛС, подробно описанных выше:
- аспирина;
- тиклопидина или клопидогреля;
- нефракционированного или низкомолекулярных гепаринов.
- блокаторов гликопротеиновых IIb/IIIа рецепторов тромбоцитов.
В некоторых кооперативных клинических исследованиях (например, ISIS-2) показано, что исход болезни улучшается даже при слабом антитромбоцитарном действии аспирина. При применении блокаторов IIb/IIIа гликопротеиновых рецепторов тромбоцитов в сочетании с низкими дозами ТАП было продемонстрировано даже более быстрое и полное восстановление коронарного кровотока, что, по мнению авторов, делает эти препараты средством выбора при проведении тромболизиса.
Реваскуляризация
В большинстве случаев после тромболизиса проводят коронароангиографию, которая позволяет объективно оценить состояние коронарного русла и результаты тромболитической терапии. В тех случаях, когда выявляется выраженный стеноз или окклюзия инфаркт-ассоциированной артерии, принимается решение о проведении реваскуляризации. Первичная транслюминальная коронарная ангиопластика осуществляется также при наличии противопоказаний к проведению тромболитической терапии. Эффективность этого метода лечения больных ИМ сопоставима с таковой при тромболитической терапии или даже превышает ее в тех случаях, когда реваскуляризация осуществляется в первые 60 мин от начала заболевания.
Методика чрескожной транслюминальной ангиопластики описана в главе 5 и разделе 6.3.
| 6.5. Осложнения инфаркта миокарда |

|
Судьба больных ИМ определяется, главным образом, наличием или отсутствием осложнений, развивающихся как на ранних, так и на поздних этапах течения заболевания.
 Запомните
1. К числу ранних осложнений ИМ, чаще всего развивающихся в острейшем или остром периодах заболевания, относятся: Запомните
1. К числу ранних осложнений ИМ, чаще всего развивающихся в острейшем или остром периодах заболевания, относятся:
| ||
| 6.5.1. Острая сердечная недостаточность | ||

| ||
Патогенез
Острая сердечная недостаточность является наиболее частой причиной смерти больных ИМ с зубцом Q (D. Аlpert, G. Frensis, 1994). Чаще всего речь идет об острой левожелудочковой недостаточности. Острая правожелудочковая недостаточность встречается значительно реже — при вовлечении в патологический процесс правого желудочка (ПЖ).
Острая левожелудочковая недостаточность обычно развивается в первые часы или дни ИМ, что связано с внезапным уменьшением массы сократительного миокарда. Факторами, способствующими возникновению острой левожелудочковой недостаточности у больных ИМ с зубцом Q, являются:
1. Значительная величина зоны некроза (более 25–30% от общей массы желудочка).
2. Выраженные нарушения сократимости миокарда ЛЖ в так называемой периинфарктной зоне — области, непосредственно граничащей с очагом некроза и, как правило, также находящейся в состоянии хронической ишемии (гибернирующий миокард) (рис. 6.42).
3. Снижение сократимости интактного миокарда, обусловленное уменьшением его коронарной перфузии (при многососудистом поражении коронарной системы), наличием в нем рубцов, гипертрофией миокарда, нарушениями метаболизма кардиомиоцитов и т.п.
4. Ремоделирование ЛЖ, в том числе его дилатация, асинергия сокращения, наличие аневризмы ЛЖ и т.д.
5. Внезапное развитие относительной митральной недостаточности вследствие дисфункции папиллярных мышц (ишемия, некроз, отрыв папиллярной мышцы).
6. Внезапный разрыв МЖП.
7. Подъем АД (увеличение постнагрузки).
8. Возникновение аритмий.

|
| Рис. 6.42. Периинфарктная зона и зона некроза при трансмуральном инфаркте миокарда с зубцом Q. Периинфарктная зона значительно увеличивает размеры инфаркта |
В результате воздействия этих и некоторых других факторов происходит критическое падение систолической функции ЛЖ, величины сердечного выброса и возрастает КДД в ЛЖ. Соответственно повышается давление наполнения ЛЖ, среднее давление в ЛП и венах малого круга кровообращения. Это затрудняет венозный кровоток в малом круге и приводит к застою крови в легких. Высокое давление в легочных венах гидравлически передается на капилляры и легочную артерию. Развивается “пассивная” венозная легочная гипертензия. Если давление в ЛП и легочных венах превышает 25–30 мм рт. ст., возникает рефлекторный спазм легочных артериол (рефлекс Китаева), в результате которого, хотя и уменьшается приток крови к легочным капиллярам из ПЖ, но одновременно резко возрастает давление в легочной артерии, развивается “активная” легочная артериальная гипертензия.
Переполнение кровью легочных капилляров и повышение давления в них выше коллоидно-осмотического давления плазмы сопровождается нарушением проницаемости сосудистой стенки и приводит к пропотеванию плазмы вначале в интерстициальное пространство, а затем в просвет альвеол (рис. 6.43). Именно эти нарушения лежат в основе приступов удушья, характерных для двух последовательных стадий гемодинамического отека легких: сердечной астмы (интерстициального отека легких) и альвеолярного отека легких. Напомним, что непосредственными причинами одышки и удушья у больных с острой левожелудочковой недостаточностью и застоем в малом круге кровообращения являются:
1. Существенные нарушения вентиляционно-перфузионных соотношений в легких (резкое замедление тока крови через нормально или даже гипервентилируемые альвеолы).
2. Отек альвеолярной стенки и повышение ригидности альвеол, что приводит к уменьшению их растяжимости.
3. Нарушение диффузии газов через утолщенную альвеолярно-капиллярную мембрану.
Все три причины ведут к уменьшению газообмена в легких и раздражению дыхательного центра.
 Запомните
Основным фактором, инициирующим застой крови в малом круге кровообращения и развитие отека легких, является повышение давления наполнения ЛЖ больше 16–18 мм рт. ст. (в норме около 5–7 мм рт. ст.). Запомните
Основным фактором, инициирующим застой крови в малом круге кровообращения и развитие отека легких, является повышение давления наполнения ЛЖ больше 16–18 мм рт. ст. (в норме около 5–7 мм рт. ст.).
|
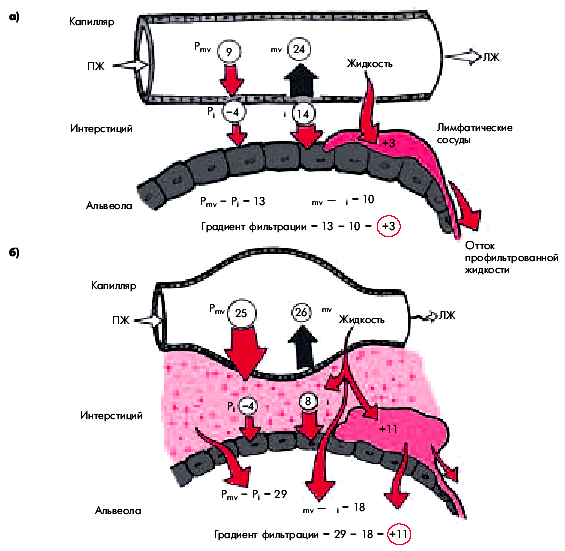
|
| Рис. 6.43. |
Интересно, что такое увеличение давления наполнения не обязательно сопровождается уменьшением ударного объема и сердечного выброса. Значения этих двух важных показателей гемодинамики некоторое время могут оставаться нормальными, несмотря на резкое падение сократительной способности ЛЖ и повышение КДД в нем. Это объясняется, в частности, действием механизма Старлинга, обеспечивающего компенсаторное увеличение УО за счет увеличения растяжения волокон миокарда дилатированного ЛЖ.
Таким образом, повышение КДД и давления наполнения ЛЖ даже при сохранении нормальных значений УО и МО, является важнейшим признаком начинающегося застоя крови в малом круге кровообращения. Дальнейший рост КДД и давления наполнения ЛЖ ведет к еще большему нарушению кровообращения в легких и снижению МО, поскольку резкое перерастяжение миокардиальных волокон уже не приводит к увеличению силы последующего сокращения (рис. 6.44).
Следует добавить, что сопутствующая гипертрофия миокарда ЛЖ и/или нарушения диастолического расслабления ишемизированного и некротизированного миокарда (диастолическая дисфункция), резкое увеличение пред- или постнагрузки или увеличение размеров полости ЛЖ также способствуют росту КДД в ЛЖ и, соответственно, давления наполнения ЛЖ, повышая риск возникновения отека легких.
Количественная оценка давления наполнения ЛЖ, МО, СИ и некоторых других гемодинамических параметров лежит в основе дифференцированного подхода к лечению ИМ, осложненного левожелудочковой недостаточностью (см. ниже).
| Рис. 6.44. | 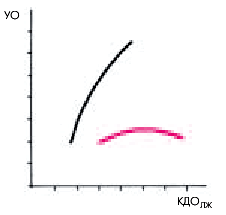
|
Клиническая картина
Острая левожелудочковая недостаточность у больных ИМ может протекать в виде трех клинических вариантов, являющихся, в известной степени, последовательными стадиями единого патологического процесса:
1. Сердечная астма возникает в результате интерстициального отека легких, не сопровождающегося значительным выходом транссудата в просвет альвеол.
2.Альвеолярный отек легких характеризуется не только гемодинамическим отеком паренхимы легких, но и выходом плазмы и эритроцитов в просвет альвеол, а затем — дыхательных путей.
3. Кардиогенный шок — крайняя степень левожелудочковой недостаточности, когда внезапное резкое снижение сердечного выброса сопровождается выраженным и часто необратимым нарушением периферического кровообращения и прогрессирующим снижением АД. Кардиогенный шок нередко сочетается с альвеолярным отеком легких.
Сердечная астма
Приступ сердечной астмы начинается внезапно с ощущения нехватки воздуха, одышки, которая быстро переходит в удушье. Больной возбужден, стремится занять возвышенное сидячее положение в постели (ортопноэ), что несколько облегчает состояние больного, создавая условия для уменьшения притока крови к правому сердцу и некоторой разгрузке малого круга кровообращения (рис. 6.45).
При осмотре, как правило, отмечается испуганное, страдальческое выражение лица. Кожные покровы влажные. Быстро нарастает цианоз, приобретающий своеобразный сероватый оттенок, характерный для прогрессирующей дыхательной недостаточности. Слизистые оболочки также синюшны.
| Рис. 6.45. | 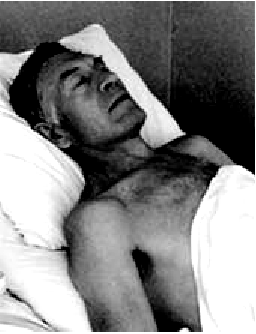
|
Дыхание учащенное, с несколько затрудненным вдохом (преимущественно инспираторная одышка). Иногда можно заметить участие в акте дыхания вспомогательной мускулатуры, в частности, выраженное втяжение межреберных промежутков и надключичных ямок во время вдоха.
В легких на фоне ослабленного везикулярного дыхания выслушивается умеренное количество влажных мелкопузырчатых незвучных хрипов, преимущественно в нижних отделах легких. Иногда можно выслушать единичные сухие хрипы.
При перкуссии нередко можно выявить умеренное смещение влево левой границы относительной тупости сердца, обусловленное дилатацией ЛЖ. Тоны сердца глухие, иногда ЧСС увеличена до 100–110 ударов в мин. На верхушке часто определяется протодиастолический ритм галопа. Артериальное давление чаще имеет тенденцию к снижению, хотя возможен и подъем АД.
Альвеолярный отек легких
При альвеолярном отеке легких к описанной выше клинической картине присоединяется шумное частое дыхание, слышимые на расстоянии крупнопузырчатые влажные хрипы (клокочущее дыхание). У больного появляется кашель с отделением жидкой пенистой (серозной) мокроты розоватового цвета за счет начавшегося пропотевания эритроцитов в просвет альвеол.
В легких на фоне ослабленного везикулярного дыхания быстро нарастает количество влажных хрипов — мелко- и среднепузырчатых, а затем и крупнопузырчатых. Хрипы вначале выслушиваются в задненижних отделах легких, постепенно распространяясь по всей поверхности легких сзади и спереди.
Тоны сердца становятся еще более глухими. На верхушке выслушивается протодиастолический или пресистолический ритмы галопа. Артериальное давление обычно продолжает снижаться. Пульс на лучевой артерии учащенный, иногда аритмичный, малого наполнения и напряжения.
Нередко клиническая картина не позволяет строго разграничить приступ сердечной астмы и начинающийся альвеолярный отек легких, хотя относительно быстрое прекращение удушья после купирования болевого синдрома, приема нескольких таблеток нитроглицерина говорит в пользу диагностики сердечной астмы.
 Запомните
1. Для интерстициального отека легких (сердечная астма) характерны приступообразно наступающее удушье, положение ортопноэ, увеличение или появление в задненижних отделах легких влажных незвонких мелкопузырчатых хрипов. 2. Для альвеолярного отека легких, сопровождающегося пропотеванием плазмы в просвет альвеол, а затем попаданием ее в бронхи и трахею и вспениванием белкового транссудата, характерно внезапно наступающее удушье, клокочущее дыхание, липкий холодный пот, пенистая кровянистая (розовая) мокрота, крупнопузырчатые влажные хрипы над всей поверхностью легких. Запомните
1. Для интерстициального отека легких (сердечная астма) характерны приступообразно наступающее удушье, положение ортопноэ, увеличение или появление в задненижних отделах легких влажных незвонких мелкопузырчатых хрипов. 2. Для альвеолярного отека легких, сопровождающегося пропотеванием плазмы в просвет альвеол, а затем попаданием ее в бронхи и трахею и вспениванием белкового транссудата, характерно внезапно наступающее удушье, клокочущее дыхание, липкий холодный пот, пенистая кровянистая (розовая) мокрота, крупнопузырчатые влажные хрипы над всей поверхностью легких.
|
Кардиогенный шок
Дата добавления: 2016-01-20; просмотров: 645;
