Робота виходу А (ф.в.)
1. Робота виходу – це характеристика властивостей речовини.
2. Визначення. Це найменша робота, яку потрібно затратити, щоб вибити електрон з поверхні металу.
3. Робота виходу – це скалярна величина.
4. Робота виходу – це таблична величина.
5. [A] = Дж. (Джоуль). Існує не системна одиниця вимірювання роботи виходу. Її називають електрон-Вольт (еВ). 1еВ = 1,6∙10-19 Кл∙1В = 1,6∙10-19 Дж.
Максимальна кінетична енергія фотоелектрона Wmax (ф.в.)
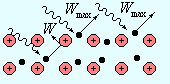
| Рис. 6.6 |
2. Визначення. Максимальна кінетична енергія електрона – це енергія електрона, що вилетів з поверхні речовини при явищі зовнішнього фотоефекту (Рис. 6.6).
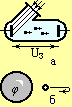
| Рис. 6.7 |
4. Максимальна кінетична енергія електрона в залежності від поставленої задачі, може бути визначена за допомогою однієї з трьох формул.
 -цю формулу використовують для визначення швидкості фотоелектрона.
-цю формулу використовують для визначення швидкості фотоелектрона.
Wmax=eUз - цю формулу використовують при визначенні затримуючої напруги для фотоелектрона (Рис. 6.7а).
*Затримуюча напруга (Uз), це найменша напруга при якій всі фотоелектрони повертаються до електрода звідки вони були вибиті.
Wmax=eφ - цю формулу використовують для визначення потенціалу, отриманого тілом внаслідок явища фотоефекту (Рис. 6.7б), де m – маса електрона v - швидкість фотоелектрону e – заряд електрону Uз - затримуюча напруга φ – потенціал , який набуває тіло в наслідок фотоефекта.
5. [Wmax] = Дж. (еВ)
Постулати Бора
Квантовою фізикою встановлено, що світло випромінюють атоми. Пояснив випромінювання атому з одним електроном датський фізик Нільс Бор.
Постулати Бора
1. Постулати Бора описують умови існування і випромінювання атомної системи (атомна система - це ядро, навколо якого обертаються електрони) .
2. Визначення.1-й постулат- атомна система може знаходитись тільки у особливих стаціонарних станах (квантових станах), яким відповідає певна енергія Wn . У стаціонарному стані атом не електромагнітні кванти не випромінює.
2-й постулат- атом випромінює електромагнітні кванти під час переходу з одного стаціонарного стану з енергією Wm в інший з енергією Wn. Енергія кванта, що випроменився дорівнює різниці енергії стаціонарних станів.
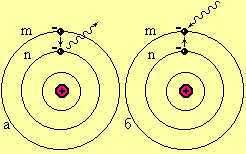
| Рисунок. 6.18 Пояснення постулатів Бора |
4. Межі застосування. Постулати Бора описують тільки атом, з одним електроном, тобто атом водню, додатній іон гелію і двічі іонізований атом літію. Усі інші атоми описуються квантовою механікою.
Випромінювання і поглинання світла атомом
Атомна система - це ядро, навколо якого обертаються електрони. Електрони можуть обертатися тільки по певним орбітам, кажуть атом може знаходитись тільки у певних стаціонарних енергетичних станах. Якщо електрон переходить з вищої орбіти на нижчу (рис. 6.18), то атом випромінює електромагнітний квант з енергією hn = Wm– Wn. Для того щоб електрон перейшов з більш низької орбіти на вищу потрібно, щоб атом поглинув електромагнітний квант з енергією hn = Wm–Wn., де Wmі Wn енергіїатомної системи(надалі ці енергії будемо називати енергетичні рівні атомної системи). Якщо енергія кванта не дорівнює різниці енергетичних рівнів (hn¹Wm–Wn). То електромагнітний квант узагалі не поглинається атомом.
Енергетичні рівні атомної системи
Кожній допустимій електронній орбіті відповідає певний енергетичний рівень, енергію якого можна знайти у вигляді суми потенціальної Wп і кінетичної енергії Wк електрона.
Потенціальна енергія електрона Wп, який знаходиться на великій відстані від ядра (R=∞) приймається рівній нулю (Wп=0). Тому всередині атома енергія електрона буде меншою, тобто від’ємною. Вона дорівнює енергії, яку необхідно затратити для переміщення електрона з орбіти атомана нескінченність проти дії електричної сили притягання.
Особливості стаціонарних станів атомної системи
1. Атомна система має безліч енергетичних рівнів.
2. Перехід атомної системи з одного енергетичного рівня на інший відбувається миттєво (t=0).
3. Стан атомної системи, при якому електрони знаходяться на будь - якому, крім першого, енергетичному рівні називається збудженим. У збудженому стані атом може перебувати не більше 10-8c. Після чого він переходить на більш низький енергетичний рівень.
4. Стан атомної системи, при якому електрони знаходяться на першому, енергетичному рівні називається не збудженим. У не збудженому стані атомна система може перебувати як завгодно довго.
93. Походження лінійчатих спектрів випромінювання атомів. Спектри випромінювання воднеподібних атомів. Формула Бальмера-Рідберга. Спектральні серії
Дата добавления: 2016-01-20; просмотров: 2768;
