МЕТОД НЕЙТРАЛИЗАЦИИ.
Вода – очень слабый электролит, диссоциирующий на ионы согласно уравнению: 2Н2О ↔ Н3О+ + ОН- или упрощенно Н2О ↔ Н+ + ОН-
Константа равновесия (диссоциации) для последнего уравнения имеет вид:
Кд = [Н+][ОН-]/ [Н2О] (1)
Так как концентрация молекул воды мало изменяется при диссоциации, величину [Н2О] считают постоянной, которую тоже можно включить в константу: [Н+][ОН-]= Кд ·[Н2О]= Кw =1·10-14 (при 22ºС) (2)
Константа Кw называется ионным произведением воды и незначительно меняется при изменении температуры. Таким образом, в чистой воде концентрация образующихся ионов составляет: [Н+]=[ОН-]= 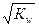 =1·10-7 моль/л. В кислой среде преобладают ионы водорода: [Н+]>[ОН-], в щелочной среде преобладают гидроксильные ионы: [ОН-]>[Н+].
=1·10-7 моль/л. В кислой среде преобладают ионы водорода: [Н+]>[ОН-], в щелочной среде преобладают гидроксильные ионы: [ОН-]>[Н+].
Для количественной характеристики кислотности среды используют водородный показатель рН и гидроксильный показатель рОН (в аналитической химии значок «р» перед искомой величиной всегда означает «-lg» от этой концентрации):
рН = -lg[Н+] ; рОН=-lg[ОН-] (3)
Логарифмируя левую и правую часть уравнения (2), получаем:
-lg([Н+]·[ОН-])= -lg10-14 => -lg[Н+]+(-lg [ОН-])= 14 => рН+рОН=14
Таким образом, сумма показателей:
рН+рОН=14 (4)
В кислой среде рН<7, в нейтральной среде рН=7, в щелочной среде рН>7.
Общая характеристика метода кислотно-основного титрования (нейтрализации)
Реакция нейтрализации – протолитическое взаимодействие кислоты и основания, в результате которого образуется соль и вода.
НА + ВОН ↔ ВА + Н2О
кисл осн соль
Несмотря на название метода, при смешении стехиометрических количеств кислоты и основания не всегда образуется нейтральная среда в точке эквивалентности (при окончании реакции), что объясняется гидролизом образующейся соли ВА. Возможны следующие случаи:
1) Если ВА образована сильным основанием и сильной кислотой (NaCl, Ba(NO3)2, и т.д.), соль не подвергается гидролизу, рНт.экв.=7.
В этом случае реакция нейтрализации действительно сводится к взаимодействию Н+ + ОН- → Н2О с образованием нейтральной среды.
2) Если ВА образована сильным основанием и слабой кислотой (K2S, CH3COONa, и т.д.), соль гидролизуется по аниону, рНт.экв.>7, среда щелочная.
3) Если ВА образована слабым основанием и сильной кислотой (CuSO4, NH4Cl, и т.д.), соль гидролизуется по катиону, рНт.экв.<7, среда кислая.
4) Если ВА образована слабым основанием и слабой кислотой (Al2S3, CH3COONH4, и т.д.), соль гидролизуется по катиону и аниону, рНт.экв.зависит от относительной силы (констант диссоциации) кислоты и основания, обычно среда близка к нейтральной.
Метод нейтрализации применяется для определения концентрации кислот, щелочей, некоторых солей, оксидов, кислотности биологических жидкостей (желудочный сок, моча, молоко), фармацевтических препаратов, продуктов питания, воды. При этом используется титрование – прибавление одного раствора (из бюретки) к другому (в колбе) по каплям с целью определения эквивалентного объема и вычисления неизвестной концентрации по закону эквивалентов. Если обозначить нормальную концентрацию титруемого раствора С1, а концентрацию титрующего раствора С2 , то закон эквивалентов («вещества реагируют в эквивалентных количествах») записывается следующим образом:
С1· V1 = С2· V2 (5),
или Скисл· Vкисл = Сосн· Vосн
Титрованный, или стандартный, раствор – раствор, концентрация которого точно известна. Титрующий раствор часто называют рабочим раствором или титрантом.
В зависимости от титранта различают ацидиметрическое и алкалиметрическое титрование. В методе ацидиметрии в качестве титрантов применяют сильные кислоты. Этим методом определяют сильные и слабые основания, соли слабых кислот и органических соединений, обладающих основными свойствами.
В методе алкалиметрии в качестве титрантов применяют сильные основания. Этим методом определяют сильные и слабые кислоты, соли слабых оснований и органических соединений, обладающих кислыми свойствами.
Основными рабочими растворами в методе кислотно-основного титрования являются чаще всего кислоты HCl и H2SO4 и растворы щелочей NaOH и KOH. Так как эти вещества не удовлетворяют требованиям, предъявляемым к стандартным веществам, из них готовят растворы приблизительной концентрации, которые затем стандартизируют.
В качестве стандартных веществ при установке точной концентрации кислот используют тетраборат натрия (буру) Na2B4O7 ·10H2O или безводный карбонат натрия Na2CO3. Для установки титра щелочей используют щавелевую кислоту H2C2O4 · 2H2O, янтарную кислоту H2C4H4O4, бензойную кислоту C6H5COOH и др.
Так как реакция нейтрализации не сопровождается каким-либо внешним эффектом, точку эквивалентности определяют по изменению окраски индикатора, который добавляют в титруемый раствор (в колбу).
Дата добавления: 2016-01-09; просмотров: 1725;
