СВОЙСТВА ОКИСЛИТЕЛЕЙ
Наиболее существенными для пиротехники свойствами окислителей являются:
1) плотность;
2) температура плавления;
3) температура интенсивного разложения;
4) теплота реакции разложения;
5) вычисляемое на основании уравнения реакции термического разложения (см. табл. 2.1) процентное содержание в окислителе активного (т. е. используемого на окисление горючего) кислорода;
6) гигроскопичность;
7) температура плавления и кипения продуктов распада. Следует отметить, что интенсивный распад окислителя в большинстве случаев протекает при температуре, равной или даже несколько большей, чем температура его плавления.
Однако понятие «температура интенсивного разложения» является часто весьма неопределенным; его следовало бы заменить значением температуры, при которой парциальное давление кислорода над окислителем равнялось бы какой-то определенной величине, например, 5 или 50 мм рт. ст. (0,66-103 или 6,6-103 Н/м2); к сожалению, для большинства окислителей таких данных пока не имеется.
Уравнения реакций термического разложения окислителей приводятся во многих справочниках. Их следует принимать во внимание, но вместе с тем учитывать, что в условиях горения составов (высокая температура+наличие восстановителя-горючего) разложение окислителей часто протекает иначе: оно становится более полным, так как весь (или почти весь) содержащийся в окислителе кислород расходуется на окисление горючего. Теплота реакции разложения вычисляется с использованием закона Гесса.
Количественная оценка гигроскопичности будет рассмотрена в § 3 этой главы.
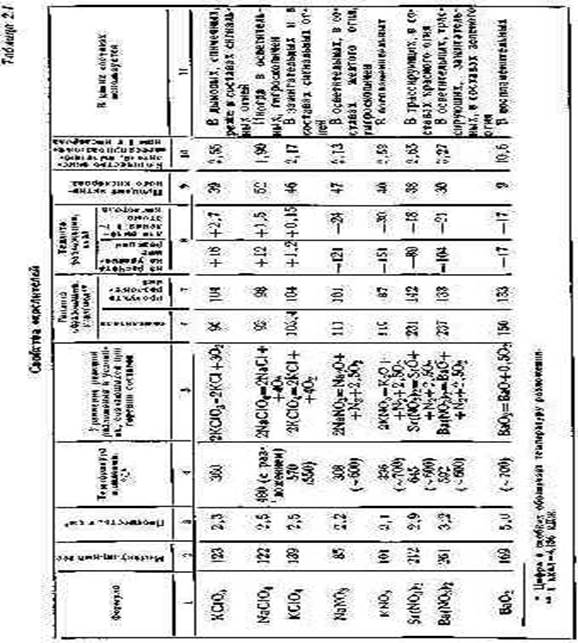
В табл. 2.1 приведены свойства наиболее часто используемых окислителей (свойства NН4С1СO4 и NH4NO3, см. в гл. XVIII).. В графе 5 приведены уравнения наиболее вероятных реакций разложения окислителей в условиях горения составов.
При низкотемпературном разложении хлорат калия разлагается с образованием перхлората и хлорида калия, но в условиях процесса горения продуктами его разложения будут только хлористый калий и кислород. Хлорат калия энергично разлагается только при температуре, превышающей его температуру плавления (370° С); добавка катализаторов резко снижает температуру его разложения. Наиболее сильное каталитическое действие при этом оказывают диоксид марганца MnO2 и оксид кобальтаCo304.
Следует заметить, что термический распад хлоратов металлов происходит тем легче, чем больше заряд и меньше радиус катиона металла.
Резкое уменьшение термической устойчивости хлоратов наблюдается по ряду Na, Mg, A1, а также по ряду Са, Mg, Be. (Эти же соображения применимы и при рассмотрении термической устойчивости нитратов металлов).
Перхлораты калия и натрия при сильном нагревании (500— 600° С) разлагаются на хлориды соответствующих металлов и кислород.
За исключением перхлората лития ни один из перхлоратов щелочных металлов не имеет определенной температуры плавления. Они либо разлагаются без плавления, либо плавятся, образуя эвтектическую смесь перхлората и продуктов его разложения. Добавление Ва(NОз)2 к КСl04 ускоряет разложение последнего.
По данным, чистый КС104 разлагается при температуре, превышающей 655° С, а смесь (50:50) Ва(NОз)2 и КС104 при температуре, большей 520° С.
Процесс разложения нитратов щелочных или щелочноземельных металлов протекает по стадиям, например:
2NaN03=2NaNO2+02;
2NaN02=Na202+N2+02;
Na202=Na20+0,502. Суммируя эти три реакции, получаем
2NaN03=Na20+N2+2,5O2—121 ккал (507 кДж).
Очевидно, в числе промежуточных продуктов разложения нитратов будут также и оксиды азота - N02 и более стойкий оксид - NO.
В тех случаях, когда в качестве горючих в составах используются неметаллы: уголь, фосфор или органические горючие, распад нитратов заканчивается образованием оксидов металлов (в данном примере Na20); если температура горения невысока, продуктах горения могут содержаться нитриты.
В случае применения в качестве горючих очень энергичных восстановителей — магния или алюминия — может произойти и более глубокий распад нитрата. Так, реакция горения смеси нитрата бария с магнием может быть выражена уравнением
Ba(N03)2+6Mg=Ba+N2+6MgO.
Реакция взаимодействия магния с оксидом бария сопровождается выделением небольшого количества тепла:
BaO+Mg=Ba+MgO+ll ккал (45 кДж).
При взаимодействии магния с оксидом натрия тепла выделится больше:
Na20+Mg=MgO+2Na+44 ккал (174 кДж).
Образование натрия при горении смесей (NаNОз+Мg), содержащих более 60% магния, было установлено экспериментально при сжигании этих смесей в калориметрической бомбе.
Температура начала разложения нитратов щелочных металлов увеличивается по ряду Na-К-Cs и равна соответственно 380, 400 и 584° С .
В результате анализа термограмм установлена температура разложения: для Са(NОз)2 480-500°, для Sг(NОз)2 580-600° и для Ва(NОз)2 555-600° С.
Известно, что окислители-соли в порядке повышения температуры разложения (при одном и том же катионе) располагаются в такой последовательности: перманганаты, хлораты, нитраты, перхлораты, бихроматы, хроматы. Температура разложения натриевых солей ниже, чем у калиевых солей с одним и тем же анионом.
Пероксид бария Ва02 легко отдает только половину содержащегося в нем кислорода, превращаясь при этом вВаО.
В графах 6 и 7 табл. 2.1 приведены значения теплоты образования окислителей и продуктов их распада.
В графе 8 дана весьма существенная характеристика окислителя: количество тепла, поглощаемое (или выделяемое) при разложении окислителя.
Для создания наиболее калорийных составов выгодно применять окислители, для разложения которых требуется минимальная затрата тепла. Однако такие составы обычно являются наиболее чувствительными к механическим воздействиям. Особенно это относится к хлоратным составам, так как при разложении хлоратов выделяется вполне ощутимое количество тепла.
Тепло, которое выделяется при разложении КСlO3, достаточно для cаморазогрева этой соли до температуры ее плавления, т. е. до 370° С.
Еще несколько более экзотермичными являются процессы разложения хлоратов натрия и бария:
2NaC103=2NaCl+302+25 ккал (104 кДж);
Ва(С10з)2=ВаС12+ЗO2+28 ккал (117 кДж).
Составы с хлоратом бария вследствие их большой чувствительности к трению и значительных взрывчатых свойств в настоящее время практически не используются.
Окислители, распад которых протекает с выделением тепла, могут обнаружить в известных условиях взрывчатые свойства и без смешения с горючими, а сами по себе - как индивидуальные вещества. Так, например, хлораты калия, натрия или бария, нагретые выше температуры плавления, взрываются от сильного удара.
Перхлорат калия КС104, взятый в отдельности, взрывчатыми свойствами не обладает, так как разложение его протекает с крайне малым выделением тепла, а именно 0,6 ккал/моль (2,5 кДж/моль).
Перхлорат натрия, вероятно, следует признать более опасным, чем перхлорат калия, так как его разложение сопровождается большим выделением тепла.
Из табл. 2.1 видно, что нитраты щелочных и щелочноземельных металлов разлагаются со значительным поглощением тепла:
это отражается, конечно, на общем тепловом балансе изготовленных с их участием составов. Количество тепла, необходимое для разложения нитратов (считая на 1 г*моль соединения), увеличивается с увеличением радиуса катиона от Li к Cs и от Be к Ва.
Затрата тепла на разложение пероксидов, в данном случае пероксида бария, сравнительно невелика. Но содержание кислорода в Ва02 мало (см. табл. 2.1), .и это сильно снижает его качество как окислителя.
Легкость отдачи кислорода окислителем и количество тепла, необходимое для его распада, тесно взаимосвязаны. Так, хлораты отдают кислород в процессе горения значительно легче (при более низкой температуре), чем нитраты; последние же отдают его легче, чем многие оксиды.
В графе 9 табл. 2.1 указан процент активного кислорода или, иначе говоря, количество граммов кислорода, освобождающегося при разложении 100 г окислителя. Эти данные вычислены на основании приведенных в графе 5 уравнений реакций разложения. Следует отметить, что интерес представляет не общее количество кислорода, содержащееся в окислителе, а то количество его, которое расходуется на окисление горючего.
Как следует из табл. 2.1, количество кислорода, отдаваемого обычно используемыми твердыми окислителями, составляет не более 52% от веса соединения.
Соли лития содержат больший процент активного кислорода:
LiNO3—58%, LiC104—60%.
Для сравнения укажем, что при разложении жидких окислителей: азотной кислоты и тетранитрометана (ТНМ) по уравнениям:
2HN03=H20+N2+2,5O2;
C(NO2)4=C+2N2+402
содержание активного кислорода в HNO3 получается равным 63%, а для ТНМ-65%. В перекиси водорода общее содержание кислорода очень велико-94%, но содержание активного кислорода составляет 47%.
Данные графы 10 используются при расчетах процентного содержания компонентов в двойных смесях.
В табл. 2.2 приведены лишь те соединения, окислительные свойства которых могут проявляться только в смесях с высококалорийными металлами (Mg, Al, Zr).
Как видно из таблицы, некоторые из окислителей (CaS04, MgCO3) содержат в себе значительное весовое количество кислорода. Но для большинства из них требуется весьма значительное количество тепла, порядка 60—70 ккал (250—290 кДж) на 1 г-атом освобождающегося при их разложении кислорода (см. графу 8). Если учесть, что при окислении магния 1-атомом кислорода выделяется 144 ккал (602 кДж), то станет ясным, что на разложение окислителей этого типа будет расходоваться 40— 50% тепла, выделяющегося при окислении высококалорийных металлов.
Вместе с тем очевидно, что большинство составов, изготовленных с использованием таких «тугих» окислителей, будет мало чувствительно к механическим импульсам, удару и трению.
Свойства окислителей (второго рода), которые могут быть использованы только в смесях с высококалорийными металлами
| Теплота образования, ккал/моль** | Теплота разложения, ккал | ||||||||||
| Формула | Молекулярный вес | Плотность г\см3 | Температура плавления, °С* | Уравнение реакции разложения в условиях, создающихся при горении составов | Окисл. Прод.разлож | Из рассчёта на уравнении реакции Для выделения 1 г атома кислорода | Процент активного кислорода | Количество окислителя, выделяющее при разложении 1г кислорода | В каких составах используется | ||
| Fез04 | 5,2 | (~1500) | FезO4=ЗFе+2O2 | —266 | —67 | 3,34 | В термитных и термитно-зажига-тельных | ||||
| МпОз | 5,0 | >530 | Мп02=Мn+O2 | —125 | —63 | 2,72 | Там же | ||||
| BaS04 | 4,5 | BaSO4=BaS+202 | —238 | —59 | •27 | 3,64 | В опытных осветительных [117] | ||||
| CaS04 | 3,0 | CaS04=CaS+202 | —227 | —57 | 2,13 | Там же |
Продолжение табл. 2.2
| Формула | Молекулярный вес | Плотность г\см3 | Температура плавления, °С* | Уравнение реакции'разложения в условиях, создающихся при горении составов | Теплота образования, ккал/моль** | Теплота разложения, ккал | Процент активного кислорода | Количество окислителя, выделяющее при разложении 1г кислорода | В каких составах используется | ||
| Окислитель | продукта разложения | Из рассчёта на уравнении реакции | Для выделения 1 г атома кислорода | ||||||||
| MgCO3 | 3,0 | (350) | MgC03=MgO+C+02 | —122 | —61 | ||||||
| Н20 | 1,0 | Н20=Н2+0,5O2 | —68 | -68 | 1,12 | В опытных смесях [29, 30] | |||||
| (СН20)n | (30)n | 1,4 | (-415) | 1/2(СН20)n=С+Н2+0,502 | —42 | —42 | 1,88 | ||||
| п | |||||||||||
| ВаСгO4 | 4,5 | 01000) | ВаСг04=ВаО+0,5Сг20з+ +0,75O2 | ВаО—133 0,5Сг203— —137 | —71 | —47 | 9,5 | 10,5 | В дистанционных | ||
| РbСг04 | 6,3 | (>850) | РЬСг04=Рb+0,5Сг20з++1,25O2 | 0,5Сг20,—137 | -85 | —34 | 12,5 | 8,0 | Там же |
* Цифра в скобках обозначает температуру разложения
*• 1 ккал-=4,186 кДж.
Многие из этих окислителей имеют положительное свойство - большую плотность.
Промежуточное положение между нитратами и сульфатами по количеству тепла, требующегося да их разложение, занимают хроматы бария и свинца; на выделение из них 1 г-атома кислорода требуется затратить соответственно 47 и 34 ккал (196 и 142 кДж). При их разложении не образуется газообразных или легколетучих продуктов, и вследствие этого их используют в безразовых составах в смеси со сплавами Zr/Ni, а также порошками вольфрама или марганца (см. гл. XIX).
В табл. 2.3 приведены данные о температуре плавления и кипения продуктов распада некоторых окислителей, по этим данным можно составить представление о налитая или отсутствии газовой фазы и жидких шлаков при горении составов, об интенсивности дымообразования в процессе горения и т. п.
Таблица 2.3
| Вещество | КС1 | NaCI | SrO | BaO | Fe | Мn | MnO |
| Температура плавления | |||||||
| Температура кипения | — | — | — |
Оксиды щелочных металлов Na20 и K2O .плавятся при температуре красного каления, т. е. примерно при 800° С.
ГИГРОСКОПИЧНОСТЬ
Весьма гигроскопичны хорошо растворимые в воде соли магния, кальция и натрия, а также многие соли аммония.
Количество воды, поглощаемой солями из воздуха, зависит от влажности и температуры воздуха, от индивидуальных свойств соли и от величины поверхности соприкосновения соли с влажным воздухом.
Если относительная влажность воздуха в помещении больше указанной в справочниках относительной влажности воздуха над насыщенным раствором соли, то соль будет притягивать к себе влагу из воздуха. Происходит так называемое «расплывание» кристаллов соли на воздухе. Если же относительная влажность воздуха в помещении мала, то влажная соль, наоборот, будет подсыхать, а в некоторых случаях будет наблюдаться
и «выветривание» из кристаллогидратов кристаллизационной воды.
Так, нитрат натрия расплывается при относительной влажности воздуха, большей 77%, а при меньшей влажности воздуха подсыхает.
Относительная влажность воздуха над насыщенным раствором соли равна отношению давления водяного пара (в мм рт. ст.) над насыщенным раствором соли (р) к давлению водяного пара над чистой водой (ро) при одной и той же температуре.
Так, например, относительная влажность над насыщенным раствором нитрата натрия при 20° С составит
p 13,5 100p
—— = ——— = 0,77 или ——— = 77
Po 17,5 Po
Имеющиеся в литературе данные о «гигроскопических точках» окислителей-солей (т. е. данные об относительной влажности воздуха над насыщенными растворами солей) при 20° С приведены в табл. 2.4.
Таблица 2.4 Гигроскопичность и растворимость окислителей-солей
| Растворимость безводной соли в воде в г | |||||
| на 100 г раствора при температуре в °С | |||||
| Соли | ____ Po | ||||
| при 20°С | |||||
| Хлораты | |||||
| КСlO3 | |||||
| NaC103 | |||||
| Перхлораты | |||||
| КClO4 | 0,7 | 1,7 | |||
| NH4Cl04 | — | ||||
| NaCl04 | 69—73 | — | |||
| Нитраты | |||||
| Ва(NОз)2 КNОз | 92,5 | 4,8 12 | 8 24 | 15 46 | |
| Рb(NОз)2 Sr(NO3)2 | 94 86 | 27 28 | 34 42 | 44 48 | 56 50 |
| NaNO3 | — | ||||
| NH4N03 |
При отсутствии таких данных о гигроскопичности соли приближенно можно судить по растворимости ее в воде. Гигроскопичность соли, как правило, будет тем больше, чем больше растворимость ее в воде.
Как видно из табл. 2.4, наименее гигроскопичны Ва(NОз)2, КС1O4, КСlOз, а затем NH4C104, Pb(NO3)2 и КNОз.
Соли, для которых «гигроскопическая точка» меньше, чем для нитрата калия, считаются гигроскопичными.
На практике затруднительна работа с солями, гигроскопическая точка которых меньше 75-80%.
Вследствие большой гигроскопичности совершенно не употребляются в пиротехнике такие соли, как Мg(NОз)2, Са(NОз)2, Мп(NOз)2, Al(N03)3, Sг(С10з)2, Ва(С104)2.
По той же причине смеси, содержащие нитрат натрия, требуют надежной изоляции их от влаги воздуха.
Нитрат стронция можно использовать, если в нем нет примесей магниевых и кальциевых солей, повышающих его гигроскопичность.
Соли тяжелых металлов в качестве окислителей почти не применяются; причиной этого является относительно малое количество содержащегося в них кислорода и то обстоятельство, что в смесях этих солей с такими металлами, как магний, цинк и т. п., при наличии влажности может протекать обменная реакция, например:
Pb(N03)2+Mg=Pb+Mg(NO3)2.
Вообще говоря, для обеспечения достаточной химической стойкости составов при хранении следует употреблять в качестве окислителей только соли тех металлов, которые в ряду напряжений (cм. табл. 2.5) стоят выше металлов, применяемых в качестве горючих.
В магниевых составах из растворимых в воде солей в качестве окислителей практически используются только соли калия, бария, стронция и натрия (литиевые соли дороги, а кальциевые соли слишком гигроскопичны).
Таблица 2.5 Стандартные электродные потенциалы при 25° С (ряд напряжений)
| Электрод | E0. в | Электрод | Eo. В |
| Li/Li1+ | +3,01 | Zn/Zn2+ | +0,76 |
| K/K1+ | +2,92 | Fe/Fe2+ | +0,44 |
| Ва/Ва2+ | . +2,92 | Sn/Sn2+ | +0,14 |
| Sr/Sr2+ | +2,89 | Pb/Pb2+ | +0,13 |
| Са/Са2+ | +2,84 | Pt(H2)/Hl+ | +0,00 |
| Na/Na1+ | +2,71 | Cu/Cu2+ | —0,34 |
| Mg/Mg2+ | +2,38 | Hg/Hg2+ | —0,80 |
| Al/Al3+ | +1,66 | Ag/Ag1+ | —0,80 |
| Mn/Mn2+ | +1,05 |
Дата добавления: 2016-01-09; просмотров: 2273;
