Кислотность, щелочность и буферность почв
Характерным свойством почвы является ее реакция. Она проявляется при взаимодействии почвы с водой или растворами солей и зависит от соотношения свободных ионов Н+ и ОН– в почвенном растворе. Кислотно-щелочные условия обусловлены типом почв, их подтиповыми, родовыми различиями и могут колебаться в широких пределах. Концентрация свободных ионов Н+ выражается величиной рН, представляющей собой отрицательный логарифм концентрации ионов водорода: рН = 7 – нейтральная реакция; рН < 7 – кислая; рН > 7 – щелочная. Показатель рН почвенного раствора в различных почвах колеблется от 3,5 до 8-9 и выше. Наиболее кислая реакция у болотных почв верховых торфяников, у подзолистых и дерново-подзолистых почв рН меняется от 4 до 6, у черноземов реакция близка к нейтральной, наиболее щелочная реакция у солончаков, особенно содовых (рН от 8-9 и выше). Для сельскохозяйственных растений наиболее благоприятна слабокислая или слабощелочная реакция; наименее благоприятна сильнокислая и особенно сильнощелочная. В кислой среде преобладает грибная микрофлора, в нейтральной и слабощелочной – бактериальная.
Реакция почвы (кислотность, щелочность) в сильнейшей степени зависит от того, какие вещества поглощены ею. Если в ППК поглощены водород или алюминий, реакция будет кислой, если натрий – щелочной; почва, насыщенная кальцием, будет иметь нейтральную реакцию.
Кислотность почв связана с содержанием ионов водорода и выражается в способности почвы подкислять воду и растворы нейтральных солей. Для почвенного раствора характерна актуальная кислотность, для твердой фазы почвы – потенциальная. В почве сохраняется подвижное равновесие ионов водорода твердой фазы и почвенного раствора, но доминирует кислотность твердой фазы почвы.
Актуальная кислотность представляет собой концентрацию ионов H+ в почвенном растворе и выражается величиной pH. Жизнь животных и растений может протекать при pH от 2,5-3 до 10-10,5. За пределами этих концентраций ионов водорода проявление жизни крайне ограничено. Величина pH является наиболее устойчивым генетическим показателем конкретной почвы. Варьирование pH в границах типичных значений составляет 5-10 %. Всякие изменения реакции среды приводят к резкой смене характера почвообразования. Антропогенные изменения актуальной кислотности происходят при окультуривании и деградации почв. Поэтому величина pH для всех почв является существенным диагностическим критерием.
Потенциальная кислотность обусловлена количеством обменных ионов H+ и Al3+ в составе почвенного поглощающего комплекса. Источником обменного иона H+ являются органические кислоты, образующиеся при разложении и гумификации органических остатков, а также угольная кислота. Обменный Al3+ вытесняется в раствор из кристаллической решетки глинистых минералов при взаимодействии с растворами солей. Выделяемые в раствор катионы H+ и Al3+ подкисляют его:
[ППК–]H+ + KCl ® [ППК–]K+ + HCl;
[ППК–]Al3+ + 3KCl ® [ППК–]3K+ + AlCl3.
Образующаяся в растворе соль хлористого алюминия относится к категории гидролитически кислых солей и в водном растворе расщепляется на кислоту и основание:
AlCl3 + 3H2O ® Al(OH)3¯ + 3HCl.
Кислотность является резко отрицательным свойством почвы, так как она угнетает развитие большинства культурных растений, усиливает разрушение минералов почвы, вызывая оподзоливание последней. Кроме того, катионы алюминия в почвенном растворе токсичны для растений. Для устранения кислотности проводят известкование почвы:
CaCO3 + H2O + CO2 = Ca(HCO3)2;
[ППК]2H+ + Ca(HCO3)2 « [ППК]Ca2+ + 2H2O + 2CO2.
Уменьшению кислотности способствует систематическое применение навоза, торфокомпостов в сочетании с агротехническими приемами окультуривания почв.
Щелочность почв представляет собой суммарное содержание в водной вытяжке карбонатных ионов 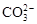 и
и 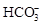 . Как и кислотность, различают щелочность актуальную и потенциальную. Актуальная обусловливается наличием в почвенном растворе гидролитически щелочных солей (Na2CO3, NaHCO3, Ca(HCO3)2, MgCO3 и др.), которые при диссоциации определяют преобладающую концентрацию гидроксил-ионов, например:
. Как и кислотность, различают щелочность актуальную и потенциальную. Актуальная обусловливается наличием в почвенном растворе гидролитически щелочных солей (Na2CO3, NaHCO3, Ca(HCO3)2, MgCO3 и др.), которые при диссоциации определяют преобладающую концентрацию гидроксил-ионов, например:
Na2CO3 + 2HOH « H2CO3 + 2Na + 2OH–.
Эти соли увеличивают концентрацию ионов OH- в почвенном растворе, реакция pH становится щелочной.
Потенциальная щелочность обнаруживается у почв, содержащих поглощенный натрий. При взаимодействии такой почвы с угольной кислотой, находящейся в почвенном растворе, происходит накопление соды и подщелачивание раствора:
[ППК–]2Na+ + H2CO3 « [ППК–]2Н+ + Na2CO3.
Щелочность угнетает развитие растений и микроорганизмов, усиливает пептизацию почвенных коллоидов и резко ухудшает физические свойства почвы. Избыточную щелочность устраняют гипсованием почвы: [ППК–]2Na+ + СaSO4 « [ППК–]Сa2+ + Na2SO4.
Буферной способностью, или буферностью, называют способность почвы противостоять изменению реакции почвенного раствора. Буферные свойства почвенного раствора связаны, главным образом, с буферностью твердой фазы почвы, с которой раствор находится в постоянном взаимодействии. Чем выше емкость поглощения почвы, тем больше ее буферная способность. Наиболее высокой буферной способностью характеризуются тяжелые хорошо гумусированные почвы.
Почвы с высокой степенью насыщенности основаниями (черноземы, каштановые, дерновые, перегнойно-карбонатные и др.) обладают высокой буферной способностью против подкисления, а не насыщенные основаниями почвы (подзолистые, красноземы и др.) – способностью против подщелачивания, так как все ионы натрия поглощаются в обмен на водород ППК.
для повышения буферности песчаных, супесчаных, дерново-подзолистых и других почв рекомендуется увеличивать емкость поглощения систематическим внесением больших норм органических удобрений.
Жидкая фаза почвы
Нормальное развитие растений и почвенных микроорганизмов невозможно без достаточного количества влаги. Вода является терморегулирующим фактором, обеспечивает протекание химических, физико-химических и биологических процессов, обусловливает физико-механические свойства почв, а также проявление некоторых негативных процессов (эрозия, вынос из верхних слоев питательных элементов).
Дата добавления: 2016-01-09; просмотров: 1279;
