Химические свойства
Кислотность и ее зависимость от строения
Важнейшее свойство карбоксильной группы — ее кислотность. То, что нам уже известно о влиянии соседних атомов на кислотность гидроксила, позволяет легко понять причины повышенной кислотности карбоксильной группы. Углерод СООН-группы, несущий частичный положительный заряд, для компенсации этого заряда перетягивает к себе электроны соседних связей, в том числе и связи С—О. Это, в свою очередь, вызывает сдвиг электронов связи О—Н в направлении кислорода и, таким образом, повышает положительный заряд на атоме водорода гидроксильной группы:
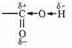
Существует и еще одна причина повышенной кислотности карбоксильной группы —мезомерия. Отрицательный заряд образующегося при диссоциации аниона не сосредоточен на одном из атомов кислорода (а), а поделен между ними (б):

На кислотность карбоксильной группы будет влиять и природа радикала, с которым эта группа связана: если этот радикал обладает способностью оттягивать на себя электроны (отрицательный индуктивный эффект -I), то кислотность будет возрастать. Так, хлоруксусная кислота диссоциирована примерно в 100 раз сильнее, чем уксусная, а трифторуксусная кислота по своей степени диссоциации не уступает сильным минеральным кислотам. Это проявление отрицательного индуктивного эффекта галогенов — их способности оттягивать электроны. Подобным же отрицательным индуктивным эффектом обладают и другие группы; по своей силе они располагаются в следующий ряд:
(CH3)3N+>NO2>CN>СНО>СО>F>Cl>Br>I>COOH>OH>NH2>H
Существуют группы и с положительным индуктивным эффектом (+I), т.е. отталкивающие электроны. По силе действия их можно расположить в следующий ряд:
Н<СН3<С2Н5<СН(СН3)2<С(СН3)3
Из-за положительного индуктивного эффекта метильной группы степень диссоциации уксусной кислоты меньше, чем муравьиной, хотя здесь действуют и другие факторы.
1) В растворах карбоновые кислоты диссоциируют:
R-COOH« RCOC-+Н+
Вследствие кислой реакции раствора они изменяют цвет индикаторов-красителей.
2) Как и неорганические кислоты, карбоновые кислоты вступают во все реакции, обусловленные наличием протона.
Они взаимодействуют с активными металлами
2RCOOH+Zn=(RCOO)2Zn+H2 с основаниями
2RCOOH+Са(ОН)2=(RCOO)2Ca+2Н2С и с основными оксидами
2RCOOH+MgO=(RCOO)2Mg+Н2O
Поскольку карбоновые кислоты являются слабыми кислотами, их соли в растворе сильно гидродизованы. Органические кислоты вытесняются из их солей при действии более сильных минеральных кислот, например
2C2H5COONa+H2SO4=2C2H6COOH+Na2SO4
За исключением муравьиной кислоты, карбоновые кислоты устойчивы к действию концентрированных минеральных кислот. Муравьиная кислота разлагается под действием концентрированной серной кислоты с образованием воды и оксида углерода (II).
3) В присутствии красного фосфора карбоновые кислоты взаимодействуют с галогенами с образованием a-галогензамещенных кислот:
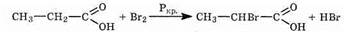
4) Карбоновые кислоты способны восстанавливаться под действием комплексных гидридов (например, LiAlH4).
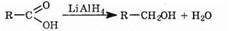
5) Окисление кислот. Предельные кислоты с нормальной углеродной цепью окисляются трудно. Кислоты с третичным атомом углерода дают при окислении оксикислоты (см. Оксикислоты). В чистом кислороде все кислоты окисляются до СО2 и Н2О.
6) Образование функциональных производных кислоты. Кислоты способны к образованию многочисленных производных, получающихся в результате реакций замещения в карбоксильной группе. Эти производные можно разбить на три основные типа:
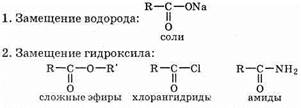
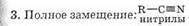
Рассмотрим подробнее образование функциональных производных кислот
Соли
Реакции образования солей карбоновых кислот при взаимодействии с металлами, основными оксидами, гидроксидами и солями более слабых кислот (карбоновые кислоты вступают в те же реакции, что и минеральные кислоты):
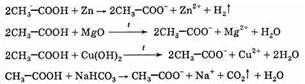
Выделение газа при обработке органического вещества насыщенным раствором гидрокарбоната натрия — качественная реакция на карбоновые кислоты, она позволяет отличить их от фенолов.
Ацетат натрия в водном растворе подвергается гидролизу (но в меньшей степени, чем фенолят):
CH3COO-Na++Н2О«СН3СОО-Н++Na++ОН-
Степень гидролиза ацетатов меди, цинка, железа больше, чем ацетата натрия.
Соли карбоновых кислот — ионные соединения, поэтому они практически нелетучи и при комнатной температуре — твердые кристаллические вещества. Соли низших кислот растворимы в воде, поскольку группа -СОО- образует водородные связи с молекулами воды. Соли высших кислот, имеющие большую по размерам углеводородную группу, растворимы в воде гораздо хуже.
Ангидриды
Общая формула ангидридов R—СО—О—СО—R'. Они являются продуктами дегидратации кислот. При их образовании молекула Воды отщепляется от двух молекул карбоновой кислоты (для этого действуют оксидом фосфора (V) Р2О5 или нагревом):

Ангидриды — очень реакционноспособные соединения. Ангидриды — летучие жидкости, с резким запахом. Большое техническое значение имеет уксусный ангидрид. Это жидкость с резким запахом, tквп=140°С.
Наибольшие количества его расходуются для получения ацетатного волокна, негорючей кинопленки. Кроме того, он применяется для синтеза фармацевтических препаратов, красителей.
Галогенангидриды
Галогенангидриды кислот получаются при действии на кис-доты неорганических галогенсодержащих веществ, например хлорида фосфора (V) РСl5:
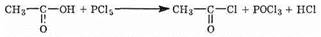
Галогенангидриды, как и ангидриды, очень реакционноспособные соединения. Они служат, в частности, для введения кислотного радикала (ацила) R—СО— в другие соединения. Такие превращения называются реакциями ангидридов и хлорангидридов со спиртами, приводят к образованию сложных эфиров:
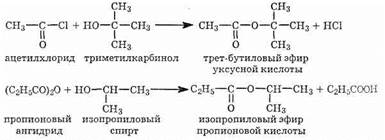
Не случайно приведенные выше примеры показывают получение сложных эфиров из вторичных и третичных спиртов. Дело в том, что обычной реакцией этерификации такие сложные эфиры получаются плохо (работа Н. А. Меншуткина): разветвленный углеродный скелет создает пространственные препятствия для реакций.
Повышенная реакционноспособность хлорангидридов в реакции этерификации объясняется тем, что у них под действием отрицательного индукционного эффекта хлора оттянуты электроны связи С®Сl и тем самым повышен положительный заряд на карбоксильном углероде:
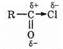
Такова же природа повышенной активности ангидридов; причиной является отрицательный индукционный эффект атома кислорода:
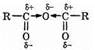
Действуя хлорангидридом на соль кислоты, можно получить ангидрид, что и используется в лаборатории:
СН3СОСl+NaOOCCH3®(СН3СО)2O+NaCl СН3СОСl+КООСС4Н9 ®СН3СО-O-ОС-С4Н9+КСl
При действии воды ангидриды и галогенангидриды легко гидролизуются с образованием кислот:
СН3СОСl+Н2O®СН3СООН+НСl
(С6Н5СО)2O+Н2O®2С6Н5СООН
Особенно легко эти реакции идут в присутствии щелочей.
Сложные эфиры
Главным способом получения сложных эфиров является реакция этерификации — взаимодействие карбоновой кислоты со спиртом в присутствии минеральной кислоты, служащей катализатором. Механизм этой реакции хорошо известен.
Реакция начинается с того, что протон (образовавшийся при диссоциации минеральной кислоты) присоединяется к карбонильному кислороду, имеющему частичный отрицательный заряд:
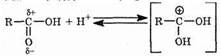
В результате на атоме углерода карбоксильной группы появляется положительный заряд, повышающий его электрофильную активность. За счет этого заряда осуществляется взаимодействие со свободной электронной парой атома кислорода спирта:

Промежуточный комплекс стабилизируется путем отщепления воды и протона:
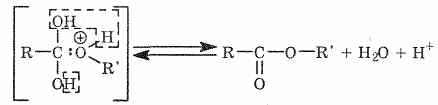
Все стадии этого процесса обратимы, поэтому обратима и вся реакция в целом. Именно присоединение протона активизирует карбоксильную группу и делает возможным последующее взаимодействие со спиртами. Таким образом, становится ясно и то, что атом кислорода спирта остается в составе сложного эфира.
Важнейшим химическим свойством сложных эфиров является гидролиз. Как и реакция этерификации, гидролиз катализируется протонами, а кроме того (в отличие от этерификации!), гидролиз ускоряется под действием оснований. Щелочной гидролиз, в отличие от кислотного, — реакция необратимая, т.к. образующаяся карбоновая кислота превращается в соль, которая со спиртом не реагирует.
Далее о сложных эфирах см. §7.6.
Амиды
Кроме сложных эфиров и солей, ангидридов и галогенангидридов, известны и другие функциональные производные карбоновых кислот — амиды.
В амидах атом азота проявляет +М (мезомерный) и -I (индуктивный) эффекты, причем +М сильнее, а -I слабее, чем группа ОН в кислотах или группа OR в сложных эфирах (вследствие меньшей электроотрицательности азота по сравнению с кислородом). В результате:
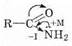
1) В амидной группе заряд d+ на атоме углерода меньше, чем в карбоксильной или сложноэфирной группах, а степень сопряжения выше (вспомним: сопряжение стабилизирует молекулу). Это приводит к низкой химической активности амидов. Например, их гидролиз до соответствующих кислот идет значительно труднее, чем гидролиз сложных эфиров (необходимо нагревание с достаточно концентрированной кислотой или щелочью):
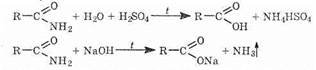
2) На атоме азота электронная плотность сильно понижена. Поэтому амиды, в отличие от аминов, не обладают свойствами оснований.
3) Полярность связи N—Н увеличена, заряд d-на кислороде оказывается также высоким (выше, чем в кислотах). Поэтому амидные группы образуют между собой водородные связи (в отличие от сложных эфиров, ангидридов, галогенангидридов и нитрилов). Это приводит к высоким температурам плавления и кипения этих веществ (ацетамид: tпл=+82°С, tкип = 221°С). Большинство амидов (кроме низших) — твердые вещества, обладающие слабым запахом. Амиды лучше других производных карбоновых кислот растворяются в воде.
Дата добавления: 2016-01-03; просмотров: 1350;
