Термические процессы
Термодинамика процессов термической деструкции
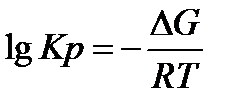
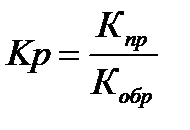 Термодинамическая вероятность протекания хим. реакции определяется величиной изменения свободной энергии Гиббса ∆G (изобарно-изотермического потенциала):
Термодинамическая вероятность протекания хим. реакции определяется величиной изменения свободной энергии Гиббса ∆G (изобарно-изотермического потенциала):
где Кпр – константа скорости прямой реакции;
Кобр – константа скорости обратной реакции.
Чтобы реакции проходила в прямом направлении скорость прямой реакции должна быть выше скорости обратной реакции, т. е. К1 > К2 в таком случае Кр будет больше 1, а lgКр > 0 . Согласно уравнению, lgКр > 0 только при условии Gт < 0. Поэтому необходимым условием протекания реакции в прямом направлении является отрицательное значение энергии Гиббса.
¢ Реакци протекает в прямом направлении, если ∆G<0
¢ Реация протекает в обратном направлении, если ∆G>0
¢ Процесс в состоянии равновесия, если ∆G=0
Термические процессы
8.1.1 Термический крекинг и пиролизуглеводородов осуществляется в отсутствии катализаторов при повышенной температуре (крекинг – 450-500 оС, пиролиз – 700-900 оС) в отсутствии воздуха
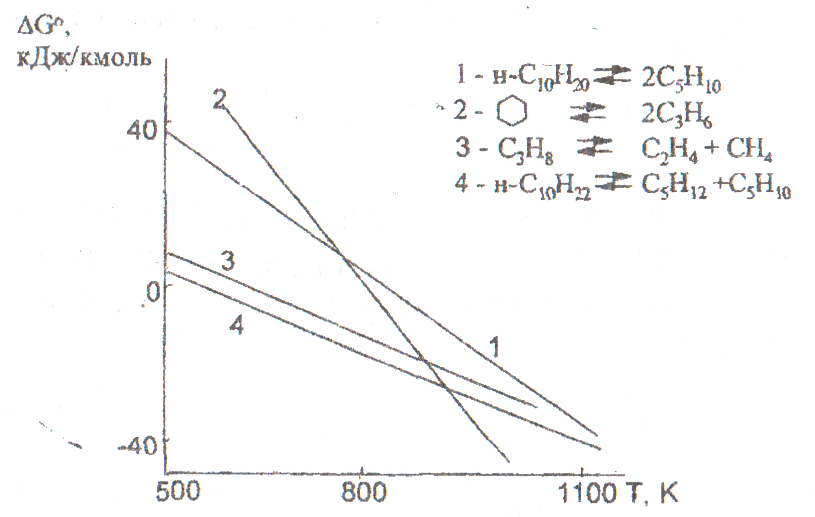
При крекинге происходит гомолитический разрыв С-С связей, а при пиролизе рвутся С-С и С-Н связи.
Механизм реакций – свободно-радикальный Þ процессы эндотермические, протекающие с увеличением объема.
Глубину превращения оценивают по ΔG.
Дата добавления: 2015-11-28; просмотров: 534;
