Химические свойства. По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее
По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, т.к. он имеет больший атомный радиус. Поскольку у атомов кремния на внешнем энергетическом уровне находится 4 электрона, то для кремния характерна степень окисления как -4, так и +4.
Кремний при обычных условиях довольно инертен, что объясняется прочностью его кристаллической решетки. Непосредственно он взаимодействует только со фтором:
Si+2F2=SiF4
Измельченный кремний при нагревании с кислородом сгорает в оксид кремния (IV):
Si+О2=SiO2
С хлором кремний реагирует при 400-600°С:
Si+2Сl2 = SiCl4
При очень высоких температурах кремний способен непосредственно соединяться с углеродом и азотом:
Si+С=SiC
3Si+2N2=Si3N4
Карбид кремния SiC (карборунд) имеет алмазоподобную кристаллическую решетку, в которой каждый атом кремния окружен четырьмя атомами углерода и наоборот, а ковалентные связи очень прочны, как в алмазе. Поэтому по твердости он близок
к алмазу. Из карбида кремния изготавливают точильные камни и шлифовальные круги.
Кислоты (кроме смеси фтороводородной HF и азотной HNO3) на кремний не действуют. Однако он растворяется в щелочах, образуя силикат и водород:
Si+2NaOH+H2O=Na2SiO3+2H2
Кремний с некоторыми металлами — Sn, Al, Zn, Pb, Au, Ag — химически не взаимодействует. С другими же металлами, например с Mg, Ca, Cu, Fe, Pt, Bi, реагирует с образованием силицидов:
2Са+Si=Ca2Si
Силициды в зависимости от структуры и свойств можно разбить на две группы. К первой относятся силициды щелочных и щелочноземельных металлов (Li4Si, Ca2Si). Они разлагаются водой и разбавленными кислотами с выделением силанов:
Ca2Si+4HCl =2СаСl2+SiH4
Наиболее интересна группа металлоподобных силицидов, образованных переходными металлами. В структуре этих силицидов цепи и слои из атомов кремния размещены в кристаллической решетке металла. Это твердые вещества с довольно высокими температурами плавления. Очень важно, что силициды не окисляются даже при высоких температурах. Так, силицид молибдена MoSi2 не изменяется на воздухе вплоть до 1600°С, что позволяет использовать его как нагреватель электрических печей.
Образование силицидных слоев на металлах широко используется для защиты от окисления и коррозии в различных химических реагентах. Многие силициды являются полупроводниками.
Силан SiH4, выделяющийся при действии на силицид соляной кислотой, является ядовитым газом с неприятным запахом. Относится к группе кремневодородов — соединениям кремния с водородом. По строению молекул кремневодороды подобны углеводородам. При комнатной температуре моносилан SiH4 и дисилан Si2H6 — газообразные вещества, остальные силаны — до последнего известного Si8H18 — летучие жидкости. Они ядовиты и имеют неприятный запах. Химически менее устойчивы, чем углеводороды.
Силаны самовоспламеняются на воздухе:
SiH4+2O2=SiO2+2Н2O
Вода разлагает силаны:
Si2H6+4Н2O=2SiO2+7Н2
Образованием и дальнейшим разложением SiH4 пользуются для получения чистого кремния в промышленности полупроводников.
Применение
Кремний используется в качестве полупроводника. Из него изготавливают так называемые солнечные батареи, превращающие световую энергию в электрическую (питание радиоустановок космических кораблей). Кремний используют в металлургии для получения кремнистых сталей, обладающих высокой жаростойкостью и кислотоупорностью.
Оксид кремния (IV)
Оксид кремния (IV) (кремнезем) — наиболее распространенное в земной коре соединение, составляющее в виде различных минералов 12% ее массы. Различают кристаллический и аморфный кремнезем.
1) Кристаллический кремнезем — в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности.
2) Аморфный кремнезем — в виде минерала опала состава SiO2•nН2О; землистыми формами аморфного кремнезема являются диатомит, трепел (инфузорная земля); примером искусственного аморфного безводного кремнезема может служить силикагель, который получают из метасиликата натрия:
Na2SiO3+2HCl=2NaCl+H2SiO3
Силикагель имеет развитую поверхность, поэтому хорошо адсорбирует влагу.
Кварц — очень твердое, прочное, тугоплавкое вещество, температура плавления 1723°С. При быстром охлаждении расплавленной массы образуется кварцевое стекло. Из него изготавливают лабораторную посуду и приборы для научных исследований.
Простейшая формула оксида кремния (IV) — SiO2. Он кристаллизуется в атомной решетке. Структуру SiO2 в плоскостном изображении можно представить так:
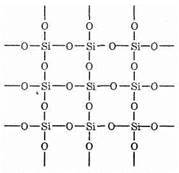
Каждый атом кремния заключен в тетраэдр из 4 атомов кислорода. При этом атом кремния находится в центре, а по вершинам тетраэдра расположены атомы кислорода. Весь кусок кремнезема можно рассматривать как кристалл, формула которого (Si02)n. Такое строение оксида кремния (IV) обуславливает его высокую твердость и тугоплавкость.
Химические свойства
В воде SiO2 практически нерастворим. Как кислотный оксид, реагирует при сплавлении с твердыми щелочами, основными оксидами и карбонатами, образуя соли кремниевой кислоты:
SiO2+2NaOH=Na2SiO3+Н2О
SiO2+CaO=CaSiO3
SiO2+Na2CO3=Na2SiO3+СO2
Кислоты не действуют на SiO2. Лишь фтороводородная кислота постепенно растворяет его:
SiO2+4HF=SiF4+2Н2O
Эта реакция лежит в основе травления стекла. Накаливание смеси SiO2 с углеродом до 2000°С приводит к образованию карбида кремния SiC, называемого карборундом: SiO2+2С=SiC+2CO
Применение
Оксид кремния (IV) широко применяется в силикатной промышленности при производстве стекла, керамики, бетонных изделий, силикатного кирпича. Чистый кварц незаменим в приборостроении. Кристаллы кварца являются пьезоэлектриками — они могут почти без потерь преобразовывать электрическую энергию в механическую. Из мелких кристаллов кварца и из отходов производства пьезоэлектрических пластин получают кварцевое
Таблица 26.
Кремниевые кислоты
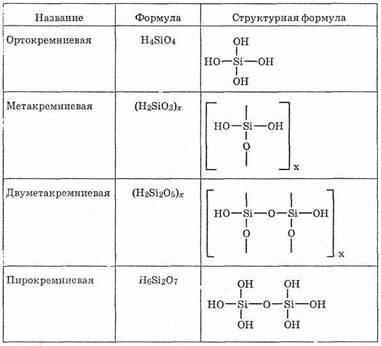
стекло. Оно прозрачно не только для видимого света, но и для ультрафиолетового, обладающего целебным действием.
Дата добавления: 2016-01-03; просмотров: 2564;
