Благородные газы. Примеры соединений криптона и ксенона
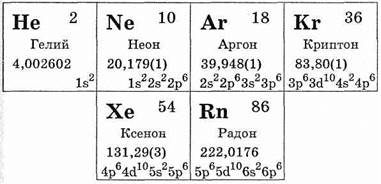
Элементы гелий, неон, аргон, криптон, ксенон, радон образуют главную подгруппу VIII группы периодической системы Д. И. Менделеева. Их атомы содержат на внешнем уровне по 8 электронов (у гелия 2). Ранее полагали, что эти элементы не способны вступать в соединения, но в настоящее время известно большое число их соединений.
Благородные газы встречаются в земной коре и в атмосфере. Содержание их в воздухе колеблется от 10-6 (ксенон) до 0,934 % по объему (аргон). В земной коре в наименьших количествах содержится радон — 4•10-17%. Содержание ксенона значительно больше — 2 • 1СГ9%. Содержание криптона — 1,9•10-8%, содержание гелия и неона приблизительно одинаково — 8 — 5•10-7%, и, наконец, содержание аргона достигает 4•10-6%. Промышленные природные месторождения гелия, как правило, находятся там, где в недрах земли залегают запасы природных газов, сопровождающих скопление нефти.
По физическим свойствам благородные газы представляют собой вещества с относительно очень низкими температурами плавления и кипения. Температура плавления гелия лежит близко от абсолютного нуля (-272,3°С). По мере роста атомной массы
Таблица 27. Свойства инертных газов
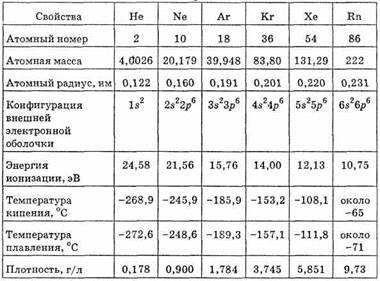
температура кипения и плавления благородных газов повышается и у радона достигает -71°С (см. табл. 27).
В начале 60-х годов были достигнуты крупные успехи в исследовании соединений элементов VIII группы. В 1962 году удалось получить тетрафторид ксенона XeF4, после чего в широких масштабах началась разработка химии благородных газов, главным образом соединений криптона и ксенона. Прочность соединений криптона и ксенона значительно больше, чем прочность других благородных газов, а разнообразие соединений криптона и ксенона оказалось очень большим.
Соединение ксенона со фтором, дифторид ксенона XeF2, было получено в результате реакции между ксеноном и гексафторидом платины:
Xe+PtF6=Xe+[PtF6]-
Позже для получения фторида ксенона применялись различные методы: нагревание фтора с ксеноном, электрический разряд, воздействие ионизирующего излучения или ультрафиолетового облучения. В итоге удалось получить дифторид ксенона XeF2, тетрафторид ксенона XeF4 и гексафторид ксенона XeF6. При нормальной температуре все это твердые вещества белого цвета. В
химическом отношении наиболее активен гексафторид ксенона XeF6. Он легко взаимодействует с кремнеземом: 2XeF6+SiO2=2XeOF4+SiF4
Окситетрафторид ксенона XeOF4 при нормальной температуре — летучая бесцветная жидкость.
Реакция тетрафторида ксенона с иодом:
5XeF4+2I2=4IF5+5Xe
сопровождается воспламенением.
Все фториды ксенона взаимодействуют с водой. При этом в реакции с дифторидом и тетрафторидом ксенона образуется ксенон, кислород и фтороводород:
2XeF2+2Н2O=2Хе+О2+4HF
XeF4+2Н2O=Хе+О2+4HF
При взаимодействии с водой гексафторида ксенона получается оксид ксенона (VI):
XeF6+Н2O= ХеO3+6HF
Оксид ксенона (VI) ХеО3 — бесцветное кристаллическое вещество, которое в твердом состоянии весьма взрывоопасно (по силе взрыва оно не уступает тринитротолуолу). В растворе же оксид ксенона (VI) устойчив и безопасен. Фториды ксенона — сильные окислители. При взаимодействии с водородом они восстанавливаются до ксенона:
XeF6+3Н2=Хе+6HF
При этом получается чистый ксенон.
Фториды ксенона проявляют окислительные свойства и по отношению к другим веществам, например:
XeF6+6KI=Хе+3I2+6KF
Вслед за фторидами ксенона в очень специфических условиях удалось получить фториды криптона — KrF2 и KrF4 — бесцветные кристаллические вещества. Они очень непрочны, разлагаются уже при комнатной температуре. Соединения неона, аргона и гелия не получены.
Из кислородных соединений помимо оксида ксенона (VI) ХеО3 получены оксид ксенона (VIII) ХеO4, а также соответствующие им кислоты Н2ХеО4 и Н4ХеO6. Сами эти кислоты неустойчивы, а их соли ксенаты (NaHXeO4 и ВаХеО4) и перксенаты (Na4XeO6 и Ва2ХеО6) при комнатной температуре представляют собой достаточно устойчивые кристаллические вещества.
Таким образом, благородные газы способны вступать в реакции и образовывать соединения с обычными ковалентными свя-
зями. Вместе с тем уже известны и химические соединения благородных газов с ионной связью. Гексафторплатинат ксенона — твердое оранжевое вещество, имеющее ионную кристаллическую решетку.
Применение
Аргон и неон применяются для наполнения ими светящихся трубок, излучающих голубой (аргон) или красный (неон) свет. Гелий используется для наполнения аэростатов; ксенон для наполнения специальных ламп. Аргон, получаемый в относительно больших количествах, применяют в качестве инертной среды при получении металлов и их сварке.
| <== предыдущая лекция | | | следующая лекция ==> |
| Требования к масштабу изображений и компоновке чертежа детали | | | Положение металлов в периодической системе. Физические свойства |
Дата добавления: 2016-01-03; просмотров: 5054;
