Механизм токсического действия. Как указывалось выше, действуя в высоких дозах, иприты (сернистый и азотистый), при резорбции, нарушают механизмы проведения нервных импульсов в синапсах
Как указывалось выше, действуя в высоких дозах, иприты (сернистый и азотистый), при резорбции, нарушают механизмы проведения нервных импульсов в синапсах (главным образом холинэргических) центральной нервной системы и на периферии. Этим, отчасти, объясняются эффекты со стороны сердечно-сосудистой системы (коллапс, брадикардия) или мозга (угнетение высшей нервной деятельности, судороги и т.д.). В последнее время появилась информация о способности ипритов вызывать индукцию и повышать активность NO-синтетазы. Поскольку установлено, что оксид азота является активным регулятором тонуса стенки сосудов и функционального состояния нервных клеток, влиянием на обмен NO также можно отчасти объяснить развивающиеся сосудистые реакции и нарушения со стороны нервной системы.
Тем не менее основным является цитотоксическое действие ипритов, лежащее в основе большинства патологических процессов развивающихся как на месте аппликации ядов, так и после их поступления во внутренние среды организма. Механизмы цитотоксичности ОВ сложны, многообразны и до конца не выяснены.
Установлено, что на клеточном уровне иприты и активные промежуточные продукты их метаболизма взаимодействуют с нуклеофильными группами молекул клеточных мембран и внутриклеточных структур, вызывая их алкилирование. Основными функционально значимыми мишенями для действия токсикантов являются белки и нуклеиновые кислоты. Взаимодействием с белками можно объяснить ингибиторную активность ипритов в отношение ряда ферментов: гексокиназы, холинацетилазы, ацетилхолинэстеразы, супероксиддисмутазы и т.д. Однако особое значение придают их повреждающему действию на дезоксирибонуклеиновые кислоты (ДНК) - формирующие генетический код клетки. В этой связи иприты относят к группе генотоксикантов (вещества, повреждающий генетический код).
В основе повреждающего действия ипритов на ДНК лежит образование ковалентных связей с пуриновыми основаниями нуклеотидов (аденином, гуанином).
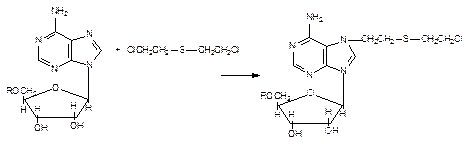
Рисунок 36. Взаимодействие аденозина с ипритом
Поскольку иприт обладает двумя функциональными группами, за счет которых осуществляется атака на нуклеофильные группы оснований (рис. 36), возможно “сшивание” комплементарных нитей двойной спирали ДНК (Папирмейстер и соавт. 1993). Уже эта реакция повреждает генетический код клеток, нарушает процессы редупликации и транскрипции, лежащие в основе синтеза белка и клеточного деления. Показано, что иприт блокирует клеточный цикл митоза обратимо в фазе G2M (синтез компонентов клеточных структур, участвующих в процессе деления клеток, например тубулина) и необратимо в фазе G1S (этап утилизации пуриновых и пиримидиновых оснований и синтеза ДНК). Тем не менее алкилирование ДНК является лишь пусковым механизмом процессов, приводящих к еще более глубокому повреждению клеток и их гибели. Как установлено, поврежденные участки ДНК подвергаются депуринизации (отщеплению алкилированных пуриновых оснований от молекулы), а затем депуринизированные участки под влиянием эндонуклеаз “вырезаются” из структуры нитей нуклеиновых кислот. Появление в ядре фрагментов ДНК активирует ферменты репарации этих макромолекул и, в частности, поли(аденозиндифосфорибозо)полимеразу (ПАФРП). Этот энзим участвует в синтезе новых фрагментов ДНК и встраивании их на место поврежденных участков. Поскольку при действии ипритов на клетки повреждаются смежные участки комплементарных нитей ДНК, в процессе репарации возможны грубые ошибки. Иными словами генетический код клетки полностью не восстанавливается. Как известно субстратом ПАФРП является никатинамидадениндинуклеотид (НАД), активно потребляемый в ходе репаративных процессов. Истощение этого субстрата (in vitro наблюдается уже через 2 часа после воздействия иприта на культуру клеток) сопровождается нарушением энергообеспечения клетки, снижается уровень АТФ. Это в свою очередь приводит к нарушению внутриклеточного обмена кальция. По данным Гросса и Смитта (1993) концентрация Са2+ в клетках, обработанных ипритом, резко увеличивается, что является пусковым механизмом каскада патологических реакций, приводящих поврежденную клетку к гибели (см. раздел “Общие механизмы цитотоксичности”). В эксперименте показано, что добавление к культуре лимфоцитов ингибиторов поли(аденозиндифосфорибозо)полимеразы (никатинамида, 3-аминобензамида) повышает резистентность клеток к иприту.
Представленные сведения объясняют, почему наибольшей чувствительностью к ипритам обладают органы и ткани, клетки которых активно размножаются (клетки эпидермиса, эпителия желудочно-кишечного тракта, костного мозга и т.д.). Именно здесь нуклеиновый обмен идет с наивысшей интенсивностью, а повреждение генетического аппарата быстро приводит к пагубным последствиям: приостанавливается процесс пополнения пула зрелых, функционально полноценных клеток, выполняющих барьерные, трофические, транспортные и иные функции.
Механизм цитотоксического действия ипритов тесно связан с метаболизмом ксенобиотика в клетках. Полагают, что в реакцию алкилирования биологических субстратов (в том числе и ДНК) вступает не сам иприт, а активные промежуточные продукты его метаболизма. Образование активных метаболитов, как указывалось, проходит при участии микросомальных монооксигеназ. Во второй фазе биопревращения иприта реактивные метаболиты вступают в реакцию конъюгации с глутатионом и детоксицируются. Такой характер превращения токсиканта создает условия для инициации свободнорадикальных процессов в клетке, во-первых, за счет активации перекисных процессов и, во-вторых, за счет подавления механизмов антирадикальной защиты. Значительное снижение уровня глутатиона в клетках после воздействия иприта и активация в них перекисного окисления липидов показаны в эксперименте (Уитфилд, 1987). Активация свободнорадикальных процессов - важный механизм повреждения клеток ксенобиотиками (см. раздел “Общие механизмы цитотоксичности”).
Результатом цитотоксического действия ипритов является инициация ряда патохимических процессов, играющих существенную роль в патогенезе интоксикации веществами. Так установлено, что под влиянием этих ядов нарушается обмен “медиаторов” воспалительной реакции - цитокинов (эндогенных регуляторов клеточного роста и активности), о чем свидетельствует изменение их уровня в крови и пораженных тканях. Имеются данные о снижении под влиянием иприта продукции интерлейкина IL-1a и увеличении продукции IL-6, IL-8. Продукция интерлейкина IL-1b и фактора некроза опухоли (ТNF-a) не изменяется. Дисбаланс в продукции цитокинов может существенно влиять на процесс развития воспалительной реакции, вызванной ипритами. Этим, вероятно, можно объяснить вялость течения патологических изменений, скудость клеточных реакций, слабость репаративных механизмов.
Таким образом, имеющиеся в настоящее время данные свидетельствуют о чрезвычайно сложном механизме действия ипритов на организм, выяснение которого чрезвычайно важно для понимания явления цитотоксичности в целом.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты кожи; средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск, проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение частичной санитарной обработки (использование ИПП) в зоне химического заражения;
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- оказания первой, доврачебной и первой врачебной (элементы) помощи пострадавшим
- подготовка и проведение эвакуации
Медицинские средства защиты и порядок их использования
После проведения санитарной обработки целесообразно применение средств, направленных на дальнейшее обезвреживание ОВ, не всосавшегося во внутренние среды организма, на поверхности кожи, слизистой глаз, в просвете желудочно-кишечного тракта, и препаратов, облегчающих состояние пораженных.
Для дегазации иприта на коже человека рекомендуется применение 2 - 5% водных растворов хлораминов (монохлорамин Б и дихлорамин Б) или 5 - 15% спиртовых растворов этих веществ. Особенностью хлораминов является их способность “догонять” иприт всосавшийся в толщу кожи и дегазировать его. Также для дегазации иприта на коже могут применяться растворы соды, аммиака, едкого натра, марганцевокислого калия, перекиси водорода. В случае сильного зуда, сопровождающего ипритную эритему можно смазывать пораженные участки кожи 5% раствором ментола.
Для обработки слизистых глаз применяют 1 - 2% растворы двууглекислой соды или борной кислоты, 0,25 - 0,5% водные растворы монохлорамина, 0,02% раствор марганцевокислого калия. При резкой отечности век и явлениях конъюнктивита делают примочки из 2% раствора хлорида кальция или содового раствора. При светобоязни - вводят 1 - 2 капли 0,5% раствора пилокарпина; при сильных болях в конъюнктивальный мешок вводят 0,25 - 0,5% раствор дикаина или 2% раствор новокаина с адреналином.
Для обработки верхних дыхательных путей делают промывание носа и полоскание рта и глотки 0,5% раствором хлорамина, 2% раствором соды или 0,1 - 0,05% раствором марганцевокислого калия. При кашле назначают противокашлевые средства тип кодеина, дионина.
В случае попадания иприта в желудок необходимо вызвать рвоту и промыть желудок. Хорошие результаты дает промывание желудка 0,05% раствором марганцевокислого калия. Целесообразно ввести в желудок активированный уголь (25 г угля на 100 мл воды).
Для уменьшения явлений общерезорбтивного действия ядов рекомендуют внутривенное введение 30% раствора гипосульфита натрия в количестве 10 - 15 мл. При явлениях возбуждения центральной нервной системы рекомендуют седативные средства из группы производных барбитуровой кислоты или бензодиазепина в обычных дозах.
Изучается возможность использования в качестве средств защиты ингибиторов NO-синтетазы (метиловый эфир L-нитроаргинина) (Соейер и соавт., 1996), антиоксидантов (токоферол, аскорбиновая кислота, глутатион и т.д.), ингибиторов поли-АДФ-рибозилирования (никатинамида, бензамида и др.) (Иорик и сотр., 1991). Однако эффективность испытанных препаратов этих групп оказалась невысокой.
Дата добавления: 2016-01-03; просмотров: 790;
