Химия элементов шестой группы – хром, молибден, вольфрам
В состав шестой группы элементов периодической системы входят хром 24Cr, молибден 42Мо, вольфрам 74W и радиоактивный металл сиборгий 106Sg. Хром встречается в природе в виде четырех стабильных изотопов, из которых преобладает 52Cr (83.8%). Природные молибден и вольфрам представляют сложную смесь, соответственно, семи и пяти изотопов, большинство из которых встречается в земной коре в сопоставимых количествах. Так, доминирующий нуклид молибден-98 составляет всего 24% от общего числа от атомов молибдена.
В 1778 г. шведский химик К. Шееле получил из минерала молибденита MoS2 оксид МоО3, при восстановлении которого углем четырьмя года позднее Р. Хьельм выделил новый элемент – молибден. Название его происходит от греческого “molybdos” (молибдос) – свинец. Конфуз связан с тем, что такие мягкие материалы, как графит, свинец и молибденит MoS2, использовали ранее как грифели для письма. C этим связано название графита “black lead” – черный свинец.
В 1781 г. К. Шееле и Т. Вергман выделили оксид нового элемента из минерала CаWO4 (шеелита). Спустя два года испанские химики – братья Дж. и Ф. д’Элуар показали, что тот же элемент является составной частью минерала (Fe, Mn)WO4 – вольфрамита. Его название происходит от немецкого Wolf Rahm – волчья пена. При выплавке олова большое количество металла терялось, переходя в шлак. Это было вызвано тем, что вольфрамит, сопутствующий касситериту, препятствовал восстановлению олова. Средневековые металлурги говорили, что вольфрамит пожирает олово, как волк овцу. Восстановлением вольфрамита углем они получили и новый металл, названный вольфрамом.
В 1797 г. французский химик Л. Воклен изучал свойства оранжево-красного минерала крокоита PbCrO4, присланного ему из Сибири русским геологом М. Палласом. При кипячении минерала с поташом он получил оранжево-красный раствор
3PbCrO4 +3K 2CO3 + H2O = Pb3(CO3)2(OH)2¯ + 3K2CrO4,+ CO2,
из которого выделил хромат калия, затем хромовый ангидрид и, наконец, восстановлением CrO3 углем – новый металл хром. Название этого элемента происходит от греческого “chroma” – цвет и связано с разнообразием окраски его соединений. Минерал хромит, важнейшее современное сырье для производства хрома, был найден на Урале в 1798 г.
Сиборгий впервые получен в 1974 г американскими учеными под руководством Алберта Гиорсо в Беркли (США). Синтез элемента в количестве нескольких атомов проводили по реакциям:
18O + 249Cf  263106Sg + 4 1n,
263106Sg + 4 1n,
248Cf + 22Ne  266106Sg + 41n
266106Sg + 41n
Период полураспада наиболее долгоживущего изотопа 266Sg равен 27,3 с. Элемент назван в честь американского физика и химика Гленна Сиборга.
Следуя общим тенденциям заполнения d-подуровня при движении по периоду для элементов шестой группы, нужно было бы предположить конфигурацию валентных электронов в основном состоянии (n-1)d4ns2 , что, однако, реализуется только в случае вольфрама. В атомах хрома и молибдена выигрыш энергии, вызванный стабилизацией наполовину заполненного подуровня и полным отсутствием дестабилизирующего вклада энергии спаривания, оказывается выше энергии, которую необходимо затратить на переход одного из s-электронов на d-подуровень. Это приводит к «перескоку» электрона (см. раздел 1.1) и электронной конфигурации (n-1)d5ns1 у атомов хрома и молибдена. Радиусы атомов и ионов (табл. 5.1) возрастают при переходе от хрома к молибдену и практически не изменяются при дальнейшем переходе к вольфраму, их близкие значения у молибдена и вольфрама являются следствием лантанидного сжатия. В то же время, несмотря на это, разница в свойствах между этими двумя элементами оказывается гораздо более заметной, чем между 4d- и 5d-элементами четвертой и пятой групп (цирконием и гафнием, ниобием и танталом): по мере удаления от третьей группы влияния лантанидного сжатия на свойства атомов ослабевает. Величины первых энергий ионизации при переходе от хрома к вольфраму увеличиваются, как и у элементов 5-ой группы.
Таблица 5.1. Некоторые свойства элементов 6-ой группы
| Свойства | 24Cr | 42Mo | 74W |
| Число стабильных изотопов | |||
| Атомная масса | 51.9961 | 95.94 | 183.84 |
| Электронная конфигурация | [Ar]3d54s1 | [Kr]4d55s1 | [Xe]4f145d46s2 |
| Атомный радиус *, (нм) | 0.128 | 0.139 | 0.139 |
| Энергии ионизации, кДж/моль: | |||
| Первая (I1) | 653,20 | 684,08 | 769,95 |
| Вторая (I2) | 1592,0 | 1563,1 | 1707,8 |
| Третья (I3) | 2991,0 | 2614,7 | |
| Четвертая (I4) | 4737,4 | 4476,9 | |
| Пятая (I5) | 6705,7 | 5258,4 | |
| Шестая (I6) | 8741,5 | 6638,2 | |
| Ионные радиусы **, нм: | |||
| Э (VI) | 0.044 | 0.059 | 0.060 |
| Э (V) | 0.049 | 0.061 | 0.062 |
| Э (IV) | 0.055 | 0.065 | 0.066 |
| Э (III) | 0.061 | 0.069 | – |
| Э (II)*** | 0.073 (нс), 0.080 (вс) | – | – |
| Электроотрицательность по Полингу | 1.66 | 2.16 | 2.36 |
| Электроотрицательность по Оллреду-Рохову | 1.56 | 1.30 | 1.40 |
| Степени окисления **** | (–4), (–2), (–1), (+2), +3, (+4), (+5), +6 | (–2), (–1), (+2), +3, (+4), (+5), +6 | (–2), (–1), (+2), (+3), (+4), +5, +6 |
* Для координационного числа КЧ = 12.
** Для координационного числа КЧ = 6.
*** Указан радиус для низко- (нс) и высокоспинового (вс) состояний.
**** В скобках указаны неустойчивые степени окисления.
В различных соединениях элементы хром, молибден и вольфрам проявляют степени окисления от –4 до +6 (табл. 5.1). Как и в других группах переходных металлов, устойчивость соединений с высшей степенью окисления, а также координационные числа возрастают от хрома к вольфраму. Хром, подобно другим d-металлам, в низших степенях окисления имеет координационное чило 6, например, [Cr(H2O)6]3+, [Cr(OH)4(H2O)2]–. По мере увеличения степени окисления ионный радиус металла неизбежно уменьшается, что приводит к понижению его координационного числа. Именно поэтому в более высоких степенях окисления в кислородных соединениях хром имеет тетраэдрическое окружение, реализуемое, например, в хроматах и дихроматах, независимо от кислотности среды. Процесс поликонденсации хромат-ионов, последовательно приводящий к дихроматам, трихроматам, тетрахроматам и, наконец, к гидратированному хромовому ангидриду, представляет собой лишь последовательное увеличение цепи из тетраэдров CrO4, соединенных общими вершинами. Для молибдена и вольфрама тетраэдрические анионы, напротив, устойчивы лишь в щелочной среде, а при подкислении повышают координационное число до шести. Образовавшиеся металл-кислородные октаэдры МО6 через общие ребра конденсируются в сложные изополианионы, не имеющие аналогов в химии хрома. С увеличением степени окисления усиливаются кислотные и окислительные свойства. Так, гидроксид Cr(OH)2 проявляет только основные, Cr(OH)3 – амфотерные, а H2CrO4 – кислотные свойства.
Соединения хрома(II) – сильные восстановители, мгновенно окисляющиеся кислородом воздуха (Рис. 5.1. Диаграмма Фроста для хрома, молибдена и вольфрама). Их восстановительная активность (Ео (Сr3+/Cr2+) = –0.41 В) сопоставима с аналогичными соединениями ванадия.
Таблица 5.2. Стереохимия некоторых соединений Cr, Mo и W
| Степень окисления | Координационные числа | Стереометрия | Cr | Mo, W |
| -4 (d10) | Тетраэдр | Na4[Cr(CO)4] | ||
| -2 (d8) | Тригональная бипирамида | Na2[Cr(CO)5] | Na2[M(CO)5] | |
| -1 (d7) | Октаэдр | Na2[Cr2(CO)10] | Na2[M2(CO)10] | |
| 0 (d6) | Октаэдр | [Сr(CO)6] | [M(CO)6] | |
| +2 (d4) | Плоскоквадратные | [Cr(acac)2] | - | |
| Квадратная пирамида | - | [Mo2Cl8]4- | ||
| Октаэдр | K4[Cr(CN)6] CrF2, CrS | Me2W(PMe3)4 | ||
| +3(d3) | Тетраэдр | [CrCl4]- | [Mo2(HPO4)4]2– | |
| Октаэдр | [Cr(NH3)6]3+ | [M2Cl9]3- | ||
| +4(d7) | Октаэдр | K2[CrF6] | [MCl6]2- | |
| Додекаэдр | - | [M(CN)6]4- | ||
| +5(d1) | Октаэдр | K2[CrOCl5] | [MF6]- | |
| +6(do) | Тетраэдр | CrO42- | MO42- | |
| Октаэдр | CrF6 | [MO6] в изополисоединениях | ||
| ? | - | [MF8]2- |
Для хрома наиболее характерна степень окисления +3 (рис. 5.1). Высокая стабильность соединений Cr(III) связана с как с термодинамическими факторами - симметричной d3 конфигурацией, обеспечивающей высокую прочность связи Cr(III) – лиганд за счет большой энергии стабилизации кристаллическим полем (ЭСКП) в октаэдрическом поле ( 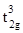 ) лигандов, так и с кинетической инертностью октаэдрических катионов хрома(III). В отличие от соединений молибдена и вольфрама в высших степенях окисления, соединения хрома(VI) – сильные окислители E0(
) лигандов, так и с кинетической инертностью октаэдрических катионов хрома(III). В отличие от соединений молибдена и вольфрама в высших степенях окисления, соединения хрома(VI) – сильные окислители E0( 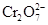 /Cr3+) = 1.33 В. Хромат-ионы могут быть восстановлены водородом в момент выделения в солянокислом растворе до ионов Cr2+, молибдаты – до соединений молибдена(III), а вольфраматы – до соединений вольфрама(V).
/Cr3+) = 1.33 В. Хромат-ионы могут быть восстановлены водородом в момент выделения в солянокислом растворе до ионов Cr2+, молибдаты – до соединений молибдена(III), а вольфраматы – до соединений вольфрама(V).
Соединения молибдена и вольфрама в низших степенях окисления содержат связи металл – металл, то есть являются кластерами. Наиболее известны октаэдрические кластеры. Так, например, дихлорид молибдена, содержит в своем составе группировки Mo6Cl8: [Mo6Cl8]Cl4. Лиганды, входящие в состав кластерного иона, связаны намного прочнее внешних, поэтому при действии спиртового раствора нитрата серебра удается осадить лишь одну треть всех атомов хлора. Связи металл-металл найдены и в некоторых соединениях хрома(II), например, карбоксилатах.
Несмотря на близость стехиометрии соединений элементов шестой группы хрома и группы серы, в атомах которых содержится одинаковое число валентных электронов, между ними наблюдается лишь отдаленное сходство. Так, например, сульфат-ион имеет те же размеры, что и хромат, и может изоморфно замещать его в некоторых солях. Оксохлорид хрома(VI) по способности к гидролизу напоминет хлористый сульфурил. В то же время, сульфат-ионы в водных растворах практически не проявляют окислительных свойств, а селенаты и теллураты не обладают способностью образовывать изополисоединения, хотя отдельные атомы этих элементов могут входить в их состав.
По сравнению с d-элементами четвертой и пятой групп катионы хрома, молибдена и вольфрама характеризуются гораздо более высокой пирсоновской «мягкостью», которая возрастает вниз по группе. Следствием этого является богатая химия сульфидных соединений, особенно развитая у молибдена и вольфрама. Даже хром, обладающий наибольшей жесткостью по сравнению с другими элементами группы, способен заменить кислородное окружение на атомы серы: так, при сплавлении оксида хрома(III) с роданидом калия может быть получен сульфид KCrS2.
5.2. Распространенность в природе. Получение и применение простых веществ.
Элементы шестой группы относятся к четным и поэтому более распространены, чем нечетные элементы 5-ой и 7-ой групп. Их природная плеяда состоит из большого числа изотопов (табл. 5.1). Наиболее распространен в природе хром. Его содержание в земной коре составляет 0.012% масс и сравнимо с распространенностью ванадия (0.014 % масс) и хлора (0.013% масс). Молибден (3×10-4% масс) и вольфрам (1×10-4% масс) относятся к редким и рассеянным металлам. Важнейший промышленный минерал хрома – хромистый железняк FeCr2О4. Реже встречаются другие минералы – крокоит PbCrО4, хромовая охра Cr2О3. Основная форма нахождения молибдена и вольфрама в природе – полевые шпаты, пироксены. Из минералов молибдена наибольшее значение имеет молибденит MoS2, в основном, благодаря тому, что он не содержит значительных количеств других металлов, что существенно облегчает переработку руды. Продуктами его окисления в природных условиях являются вульфенит PbMoО4 и повеллит CaMoO4. Важнейшие минералы вольфрама – шеелит CaWO4 и вольфрамит (Fe,Mn)WO4, однако среднее содержание вольфрама в рудах крайне низко – не более 0,5%. Благодаря близости свойств молибдена и вольфрама, существуют полные твердые растворы СаМоО4-CaWO4 и PbMoO4-PbWO4.
Для многих технических целей нет необходимости разделять железо и хром, содержащиеся в хромистом железняке. Сплав, образующийся при восстановлении его углем в электропечах
FeCr2O4 + 4C 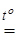 Fe + 2Cr + 4CO,
Fe + 2Cr + 4CO,
под названием феррохром широко применяется в производстве нержавеющих сталей. Если в качестве восстановителя используют кремний, то получают феррохром с низким содержанием углерода, идущий на производство прочных хромовых сталей.
Чистый хром синтезируют восстановлением оксида Cr2O3 алюминием
Сr2O3 + 2Al = 2Cr + Al2O3
или кремнием
2Cr2O3 + 3Si = 4Cr + 3SiO2.
При алюминотермическом способе предварительно подогретую шихту из оксида хрома(III) и порошка алюминия с добавками окислителя (Сноска: теплоты, выделяющейся при восстановлении оксида хрома алюминием, недостаточно для самопроизвольного протекания процесса. В качестве окислителя используют дихромат калия, пероксид бария, хромовый ангидрид) загружают в тигель. Реакцию инициируют поджиганием смеси алюминия и пероксида натрия. Чистота получаемого металла определяется содержанием примесей в исходном оксиде хрома, а также в восстановителях. Обычно удается получить металл 97-99%-ной чистоты, содержащий небольшие количества кремния, алюминия и железа.
Для получения оксида хромистый железняк подвергают окислительному плавлению в щелочной среде
4FeCr2O4 + 8Na2CO3 + 7O2 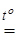 8Na2CrO4 + 2Fe2O3 + 8CO2,
8Na2CrO4 + 2Fe2O3 + 8CO2,
а образующийся при этом хромат Na2CrO4 обрабатывают серной кислотой.
2Na2CrO4 + 2H2SO4 = Na2Cr2O7 + 2NaHSO4 + H2O
На некоторых промышленных установках вместо серной кислоты используют углекислый газ, проводя процесс в автоклавах под давлением 7 – 15 атм.
2Na2CrO4 + H2O + 2CO2 = Na2Cr2O7 + 2NaHCO3.
При обычном давлении равновесие реакции смещено влево.
Затем выкристаллизовавшийся бихромат натрия Na2Cr2O7×2Н2О обезвоживают и восстанавливают серой или углем
Na2Cr2O7 + 2C 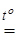 Cr2O3 + Na2CO3 + CO.
Cr2O3 + Na2CO3 + CO.
Наиболее чистый хром в промышленности получают либо электролизом концентрированного водного раствора хромового ангидрида в серной кислоте, раствора сульфата хрома(III) Cr2(SO4)3 или хромо-аммонийных квасцов. Хром чистотой выше 99 %, выделяется на катоде, выполненном из алюминия или нержавеющей стали. Полная очистка металла от примесей азота или кислорода достигается выдерживанием металла в атмосфере водорода при 1500 °C или перегонкой в высоком вакууме. Электролитический способ позволяет получать тонкие пленки хрома, поэтому он используется в гальванопластике.
Для получения молибдена обогащенную методом флотации руду обжигают
900 – 1000 ºС
2MoS2 + 7O2 = 2MoO3 + 4SO2.
Образующийся оксид при температуре реакции отгоняется. Затем его дополнительно очищают возгонкой или же растворяют в водном растворе аммиака
3MoO3 + 6NH3 + 3H2O = (NH4)6Mo7O24,
перекристаллизовывают и вновь разлагают на воздухе до оксида. Порошок металла получают восстановлением оксида водородом:
1000ºC
MoO3 + 3H2 = Mo + 3H2O,
прессуют и сплавляют в дуговой печи в атмосфере инертного газа либо переводят в слиток методом порошковой металлургии. Суть его заключается в производстве изделия из тонких порошков путем формования холодным прессованием и последующей высокотемпературной обработкой. Технологический процесс изготовления изделий из металлических порошков включает подготовку смеси, формование заготовок или изделий и их спекание. Формование осуществляется путем холодного прессования под большим давлением (30–1000 МПа) в металлических формах. Спекание изделий из однородных металлических порошков производится при температуре, достигающей 70–90 % температуры плавления металла. Во избежание окисления спекание проводят в инертной, восстановительной атмосфере или в вакууме. Так, порошок молибдена сначала прессуют в стальных пресс-формах. После предварительного спекания (при 1000-1200 °C) в атмосфере водорода заготовки (штабики) нагревают до 2200-2400 °C. При этом отдельные кристаллиты плавятся с поверхности и слипаются друг с другом, образуя единый слиток, который подвергают ковке.
Исходным веществом для производства вольфрама служит его оксид WO3. Для его получения руду (шеелит CaWO4 или вольфрамит FeWO4), предварительно обогащенную флотацией в растворах поверхностно-активных веществ, подвергают щелочному или кислотному вскрытию. Щелочное вскрытие проводят, разлагая концентрат в автоклавах раствором соды при 200 оС
200 ºC
CaWO4 + Na2CO3 =Na2WO4 + CaCO3¯ .
Равновесие смещается вправо за счет использования трехкратного избытка соды и выпадения в осадок карбоната кальция. По другому методу вольфрамитовые концентраты разлагают нагреванием с крепким раствором едкого натра или спеканием с содой при 800-900 °C
900 ºC
CaWO4 + Na2CO3 =Na2WO4 + CO2 + CaО.
Во всех случаях конечным продуктом разложения является вольфрамат натрия, который выщелачивают водой. Образовавшийся раствор подкисляют и осаждают вольфрамовую кислоту
Na2WO4 + 2HCl = H2WO4¯ + 2NaCl.
Кислотное вскрытие шеелита также приводит к вольфрамовой кислоте:
CaWO4 + 2HCl = H2WO4¯ + CaCl2.
Выделившийся осадок вольфрамовой кислоты обезвоживают
800 ºС
H2WO4 = WO3 + Н2О.
Образующийся при этом оксид восстанавливают водородом
850 оС
WO3 + 3H2 = W + 3Н2О.
Оксид, идущий на производство вольфрама высокой чистоты, предварительно очищают растворением в аммиаке, кристаллизацией паравольфрамата аммония и последующим его разложением.
При восстановлении оксида металлический вольфрам также получается в виде порошка, который прессуют и спекают при 1400 ºС, а затем нагревают штабик до 3000 ºС, пропопуская через него электрический ток в атмосфере водорода. Приготовленные таким способом вольфрамовые штабики приобретают пластичность, из них, например, вытягивают вольфрамовые нити для электрических ламп накаливания. Крупнокристаллические слитки вольфрама и молибдена получают электронно-лучевой плавкой в вакууме при 3000-3500 оС.
Хром применяется в металлургии при производстве нержавеющих сталей, обладающих уникальной устойчивостью к коррозии. Добавление к железу всего нескольких процентов хрома делает металл более восприимчивым к термической обработке. Хромом легируют стали, идущие на изготовление пружин, рессор, инструментов, подшипников. Дальнейшее увеличение содержания хрома в стали приводит к резкому изменению ее механических характеристик – снижению износостойкости, появлению хрупкости. Это связано с тем, что при содержании в стали хрома более 10 % весь содержащийся в ней углерод переходит в форму карбидов. В то же время такая сталь практически не подвержена коррозии. Нержавеющая сталь самой распространенной марки содержит 18 % хрома и 8 % никеля. Содержание углерода в ней очень невелико – до 0,1 %. Из нержавеющей стали изготавливают лопатки турбин, корпуса подводных лодок, а также трубы, металлочерепицу, столовые приборы. Значительное количество хрома идёт на декоративные коррозионно-стойкие покрытия, которые не только придают изделиям красивый внешний вид и увеличивают срок их эксплуатации, но и усиливают износостойкость деталей машин и инструмента. Хромовое покрытие с подслоем меди и никеля хорошо защищает сталь от коррозии, придавая изделиям красивый внешний вид. Защитно-декоративному хромированию подвергают детали автомобилей, велосипедов, приборов, в них толщина наносимой пленки обычно не превышает 5 мкм. По отражательной способности хромовые покрытия уступают лишь серебряным и алюминиевым, поэтому их широко используют в производстве зеркал, прожекторов. Никелевые сплавы, содержащие до 20 % хрома (нихромы), применяются для изготовления нагревательных элементов – они обладают высоким сопротивлением, и при прохождении тока сильно нагреваются. Добавка к таким сплавам молибдена и кобальта сильно увеличивает их жаростойкость – из таких сплавов делают лопатки газовых турбин. Наряду с никелем и молибденом, хром входит в состав металлокерамики – материала, используемого при протезировании зубов. Соединения хрома используются в качестве зеленых (Cr2O3, CrOOH), желтых (PbCrO4, CdCrO4) и оранжевых пигментов. Многие хроматы и дихроматы находят применение в качестве ингибиторов коррозии (CaCr2O7, Li2CrO4, MgCrO4), средств сохранения древесины (CuCr2O7), фунгицидов (Cu4CrO7×xH2O), катализаторов (NiCrO4, ZnCr2O4). Мирвоое производство хрома в настоящее время превышает 700 тыс. тонн в год.
Молибден также используют в металлургии для создания твердых и износоустойчивых, химически стойких и жаропрочных конструкционных сплавов, в качестве легирующей добавки к броневым сталям. Коэффициенты термического расширения молибдена и некоторых сортов стекла (их называют «молибденовым стеклом») близки, поэтому из молибдена изготавливают вводы в стеклянные электровакуумные приборы и колбы мощных источников света. Благодаря сравнительно малому сечению захвата тепловых нейтронов (2,6 барн), молибден применяют в качестве конструкционного материала в ядерных реакторах. Молибденовая проволока, ленты и прутки служат нагревательными элементами, теплозащитными экранами в вакуумных установках. Молибден, легированный титаном, цирконием, ниобием, вольфрамом, используется в авиации и ракетной технике для изготовления газовых турбин и деталей двигателей.
Вольфрам – лучший материал для нитей и спиралей в лампах накаливания, катодов радиоламп и рентгеновских трубок. Высокая рабочая температура (2200-2500 оС) обеспечивает большую светоотдачу, а низкая скорость испарения и способность удерживать форму, (не провисать при нагревании до 2900 оС) – длительный срок службы нитей накаливания. Вольфрам применяют также для создания твердых, износоустойчивых и жаропрочных сплавов в машиностроении, ракетной технике. Стали, содержащие 20% вольфрама, обладают способностью к самозакалке – из них изготовляют лезвия режущих инструментов. Вольфрамовые сплавы выгодно сочетают жаропрочность и жаростойкость не только на влажном воздухе, но и во многих агрессивных средах. Например, при введении в никель 10% вольфрама, его коррозионная устойчивость возрастает в 12 раз. Вольфрам-рениевые термопары позволяют измерять температуры до 3000 оС.
| <== предыдущая лекция | | | следующая лекция ==> |
| Изменяющееся во времени электрическое поле порождает в окружающем пространстве магнитное поле. | | |
Дата добавления: 2016-01-03; просмотров: 3874;
