Скорость химических реакций. Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах
Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой.

При этом безразлично, о каком участвующем в реакции веществе идет речь: все они связаны между собой уравнением реакции, и по изменению концентрации одного из веществ можно судить о соответствующих изменениях концентраций всех остальных.
Рассмотрим в общем виде скорость реакции, протекающей по уравнению
A+B=C+D
По мере расходования вещества А скорость реакции уменьшается. Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как концентрация вещества А в момент времени t1 измеряется величиной c1 а в момент времени t2 — величиной с2 , то за промежуток времени Dt=t2-t1 изменение концентрации вещества составит Dс=с2-с1, откуда определится средняя скорость реакции (v^):
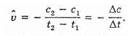
Знак минус ставится потому, что, несмотря на убывание концентрации вещества А и, следовательно, на отрицательное значение разности с2-c1 скорость реакции может быть только положительной величиной. Можно также следить за изменением концентрации одного из продуктов реакции — веществ С или D;
она в ходе реакции будет возрастать, и поэтому в правой части уравнения нужно поставить знак плюс.
Обычно концентрацию выражают в моль/л, а время — в секундах или минутах. Если, например, исходная концентрация одного из реагирующих веществ составляла 1 моль/л, а через 4 с от начала реакции она стала 0,6 моль/л, то средняя скорость реакции будет равна -(0,6-1)/4=0,1 моль/(л•с).
Поскольку скорость реакции все время изменяется, то в химической кинетике рассматривают только истинную скорость реакции v, т.е. скорость в данный момент времени.
Дата добавления: 2016-01-03; просмотров: 594;
