I– < Br– < S2– < Cl– < NO3– < F– < OH– < C2O42– < H2O < NH3 < en < bipy < phen < NO2– < CN– < CO
Слабое поле сильное поле
Среднее поле
Frac34;¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® Δo
Лиганды слабого поля с элементами 3d-ряда образуют высокоспиновые комплексы, а лиганды сильного поля – низкоспиновые. Различие между ними сказывается на электронном строении комплексов лишь для конфигураций d4 – d7:
[Fe(H2O)6]3+ d5 [Fe(CN)6]3– d5

высокоспиновый комплекс низкоспиновый комплекс
H2O – лиганд слабого поля CN– – лиганд сильного поля
Низкоспиновые комплексы всегда устойчивее высокоспиновых. Лиганды среднего поля в зависимости от условий (заряд и природа центрального атома) могут образовывать как высокоспиновые, так и низкоспиновые комплексы.
Пример. На основании ТКП выскажите предположение об электронном строении ионов гексаамминкобальта(II) (Δo = 21600 см–1, Р = 21000 см–1) и гексаамминкобальта(III) (Δo = 9500 см–1, Р = 22500 см–1).
Аммиак – лиганд среднего поля и в зависимости от степени окисления металла может образовывать как высокоспиновые, так и низкоспиновые комплексы. Выясним, какие комплексы будут энергетически более устойчивы для кобальта(II) и кобальта (III). Для этого сравним ЭСКП каждого из ионов в сильном и слабом поле:
(а) [Co(NH3)6]3+, d6

сильное поле слабое поле
ЭСКП (сильное поле) = –6´(2/5)Δo + 2P = –6´(2/5) ´21600 + 2´21000 = –9840 см–1
ЭСКП (слабое поле) = –4´(2/5)Δo + 2´(3/5)Δo = –4´(2/5) ´21600 + 2´(3/5) ´21600 = –8640 см–1
Энергетический выигрыш больше в случае низкоспинового комплекса.
(б) [Co(NH3)6]2+, d7
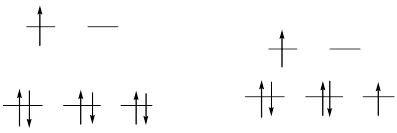
сильное поле слабое поле
ЭСКП (сильное поле) = –6´(2/5)Δo + 1´(3/5)Δo + P = –6´(2/5)´9500 + 1´(3/5) ´9500 + 22500 = 7900 см–1
ЭСКП (слабое поле) = –5´(2/5)Δo + 2´(3/5)Δo = –5´(2/5) ´9500 + 2´(3/5) ´9500 = –7600 см–1
Энергетический выигрыш больше в случае высокоспинового комплекса.
Таким образом, ион [Co(NH3)6]3+ является низкоспиновым, а [Co(NH3)6]2+ - высокоспиновым.
ЭСКП возрастает с увеличением Δo, однако, различно для высокоспинового и низкоспинового состояний (Рис. 1.28. Зависимость ЭСКП для высокоспинового и низкоспинового комплексов с конфигурацией d6 от величины Δo = 10Dq. Область, в которой возможно существование обоих состояний, заштрихована). Область вблизи точки пересечения этих двух прямых соответствует комплексам, способным существовать как в высокоспиновом, так и в низкоспиновом состояниях.
Примером может служить тиоцианатный комплекс железа(II) с 1,10-фенантролином [Fe(phen)2(NCS)2], который при низких температурах высокоспиновый (парамагнитный), а при повышении температуры – низкоспиновый (диамагнитный) (M. Marchivie, P. Guionneau, J. A. K. Howard, G. Chastanet, J.-F. Letard, A. E. Goeta, D. Chasseau, J. Am. Chem. Soc., 2002, v. 124, p. 194). Изменение мультиплетности сопровождается изменением межатомных расстояний и геометрии координационного окружения: низкоспиновый комплекс представляет собой правильный октаэдр, а высокоспиновый – искаженный. Обратный переход в высокоспиновое состояние возможен под действием высоких давлений или излучения. В настоящее время известно несколько десятков подобных систем.
Говоря о σ-донорных и π-акцепторных свойствах лиганда, мы вышли за рамки ТКП, используя подходы метода молекулярных орбиталей применительно к комплексным соединениям (том 1). Напомним, что картина расщепления d-орбиталей является фрагментом общей схемы молекулярных орбиталей в октаэдрическом комплексе, где t2g-орбитали рассматриваются как несвязывающие, а eg – как разрыхляющие (рис. том 1).
В образовании связей в октаэдрическом комплексе без π-связывания участвуют s-, p- и d-орбитали металла и по одной орбитали от каждого лиганда. Из 15 атомных орбиталей образуется 15 молекулярных, шесть из них (a1g, t1u, eg (сноска: буква в обозначении орбиталей указывает на степень их вырожденности: t – трижды вырожденные, e – дважды вырожденные, a – невырожденные, и на наличие центра симметрии: g – симметричные, u - несимметричные)) σ-связывающие, три (t2g) – несвязывающие, и шесть (eg*, t1u*, a1g*) σ-разрыхляющие. Связывающие орбитали по энергии ближе к орбиталям лиганда, а несвязывающие локализованы преимущественно на атоме металла. Энергия dxy, dxz, dyz (t2g) орбиталей металла при образовании комплекса практически не изменяется.
Наличие у лиганда низкой по энергии вакантной орбитали, сходной по симметрии с орбиталями металла, приводит к понижению энегии t2g-орбиталей, практически не влияя на eg, тем самым увеличивая Δо (Рис. 1.29. Фрагменты диаграммы МО для комплекса кобальта(III) с σ-донорным лигандом (а) и σ-донорным, π-акцепторным лигандом (б)).
Эффект Яна-Теллера. В 1937 г. Ян и Теллер доказали теорему, согласно которой любая нелинейная молекула в вырожденном электронном состоянии неустойчива и самопроизвольно претерпевает искажение, понижающее ее симметрию и приводящее к снятию вырождения. Теорема предсказывает лишь сам факт снятия вырождения, но не указывает, каким образом оно будет снято. На основании этой теоремы получило объяснение искажение октаэдрической геометрии ряда комплексов, а сам факт наличия такого искажения получил название эффекта Яна-Теллера. Обратимся к примеру. Комплексы меди(II) с конфигурацией d9, как правило, не представляют собой правильный октаэдр, а вытянуты или сжаты по одной из осей (Рис. 1.30. Искажение октаэдрической геометрии в комплексах меди (II)). Рассмотрим случай вытянутого октаэдра. Удаление лигандов, расположенных по оси z, вызывает снятие вырождения вследствие изменения энергий орбиталей. Орбитали, направленные по оси z (dxz, dyz, dz2), слабее взаимодействуют с орбиталями лигандов по сравнению с орбиталями, не имеющими z-компоненты (dxy, dx2-y2), и поэтому понижают свою энергию. Пара орбиталей одинаковой симметрии, имеющие z-компоненту (dxz, dyz), остается вырожденной и приобретает повышенную энергию. (Рис. 1.31. Изменение энергий d-орбиталей при искажении октаэдра). Эффект Яна-Теллера с наибольшей силой проявляется в комплексах с неравноценно заполненными eg-орбиталями, то есть с конфигурациями t2g3eg1 (соответствует иону d4 в слабом поле: CrCl2, K3MnF6) и t2g6eg3 (соответствует иону d9: практически все комплексы меди(II)) и t2g6eg1 (соответствует иону d7 в сильном поле, встречается редко, K3NiF6),. Незначительный эффект Яна-Теллера характерен для комплексов с неравноценно заполненными t2g-орбиталями, то есть для электронных конфигураций t2g1 (d1), t2g2 (d2), t2g4 (d4 в сильном поле), t2g5 (d5 в сильном поле), t2g5eg1 (d6 в слабом поле), t2g5eg2 (d7 в слабом поле). Ионы с конфигурациями d3 и d5 в слабом поле, d3 и d6 в сильном поле, d8 и d10 ни при каких условиях не являются ян-теллеровскими.
Эффект Яна-Теллера проявляется в неравноценности длин связей во многих комплексах меди(II) и марганца(III), в немонотонном изменении ступенчатых констант устойчивости комплексов. Например, в безводном хлориде меди(II) атом меди расположен в окружении из шести атомов хлора, четыре из которых находятся на расстоянии 0,230 нм, а два других удалены от него на 0,295 нм.
Известны комплексы меди(II) ([Cu(en)3]Cl2, [Cu(H2O)6](C6H5SO3)2 и др), состоящие из нескольких кристаллографически неэквивалентных ян-теллеровских ионов, каждый со своим типом искажения, которые превращаются друг в друга, изменяя расстояние металл-лиганд настолько быстро, что в целом все расстояния металл-лиганд кажутся одинаковыми. Этот случай получил название динамического, или пульсирующего эффекта Яна-Теллера (P. E. M. Wijnands, J. S. Wood, J. Redijk, W. J. A. Maaskant, Inorg. Chem., 1986, 35, 1214) .
Эффект Яна-Теллера, тем не менее, не относится к всеобщим законам. В настоящее время известны комплексные ионы с ян-теллеровской конфигурацией, представляющие собой неискаженные октаэдры: [Cu(NO2)6]4–, [Mn(H2O)6]3+.
Расщепление в полях с симметрией, отличной от октаэдрической.
Помимо октаэдрических, известно множество комплексов с иной геометрией – плоско-квадратных, тетраэдрических, тригонально-пирамидальных, квадратно-пирамидальных, линейных и др. Расщепление в каждом из этих полей иное, чем в октаэдре, оно определяется симметрией координационного полиэдра.
Плоско-квадратные комплексы можно рассматривать как предельный случай тетрагонального искажения октаэдрической геометрии, когда лиганды, расположенные по одной из координатных осей, удалены в бесконечность (Рис. 1.27б). Обозначения орбиталей приведены на рисунке. Плоско-квадратные комплексы наиболее типичны для ионов с электронной конфигурацией d8 – Ni2+, Pd2+, Pt2+, Au3+. Их устойчивость резко возрастает при увеличении Δ, то есть при переходе от элементов 3d-ряда к тяжелым переходным элементам. Так, например, если у палладия, платины и золота практически все комплексы с координационным числом четыре квадратные, то никель образует плоско-квадратные комплексы лишь с лигандами сильного поля: [Ni(CN)4]2– , Ni(dmg)2. Комплексы никеля(II) с лигандами слабого поля, например, с галогенами, имеют тетраэдрическую геометрию.
Некоторые плоско-квадратные комплексы переходных металлов в твердом виде образуют цепи с мостиковыми лигандами, например, Pt-CN-Pt в K2[PtCl4]Br0,3, где атомы платины частично находятся в степени окисления +4. Высокая проникающая способность 5d-орбиталей обеспечивает их перекрывание с образованием единой энергетической зоны, а, следовательно, и металлическую проводимость по направлению цепи. Такие молекулярные комплексы способны проводить электрический ток, и в настоящее время интенсивно изучаются.
В поле тетраэдрической симметрии максимальной энергией обладают орбитали dxy, dyz, dxz, их называют t2-орбиталями, а минимальной – орбитали dx2–y2 и dz2, их обозначают e. Из-за наличия меньшего числа лигандов и иного их расположения тетраэдрическое поле (Рис. 1.32. Сравнение расщеплений в тетраэдрическом и октаэдрическом поле) оказывается в 2,25 раза слабее октаэдрического:  .
.
Большинство тетраэдрических комплексов высокоспиновые.(Сноска – Известны несколько примеров низкоспиновых тетраэдрических комплексов, например, Cr{N(Si(CH3)3)2}3NO (хром(II), d4; D. C. Bradley, Chem. Ber., 1979, 11, 393); CoL4, где L – 1-норборнил (кобальт(IV), d5; E. K: Brune, D. S. Richeson, K. H. Theopold, Chem. Commun., 1986, 1491)). Максимальная стабилизация тетраэдрического окружения кристаллическим полем достигается при конфигурациях d2 (FeO42–, MnO43–) и d7 ([CoCl4]2–). По причине относительно низкой энергии стабилизации тетраэдрические комплексы образуются чаще ионами с конфигурациями d0 (TiCl4, MnO4–, CrO42–), d5 в слабом поле (FeCl4–) и d10 (ZnCl42–) с нулевой ЭСКП, а также ионами непереходных металлов (AlCl4–). Образованию тетраэдрических комплексов по сравнению с октаэдрическими часто благоприятствует стерический фактор, так, ион [FeBr4]– более устойчивый, чем [FeBr6]3–.
Использование ТКП для объяснения устойчивости комплексов. Ряд Ирвинга-Уильямса. Теория кристаллического поля позволяет объяснить немонотонный характер изменения энергий кристаллической решетки оксидов и галогенидов, констант устойчивости комплексов и др. Порядок изменения энергий гидратации двухзарядных катионов 3d-металлов в целом совпадает с характером изменения ЭСКП в высокоспиновых комплексах (Рис. 1.33. Изменение энергии гидратации двухзарядных катионов металлов 3d-ряда (а) и изменение ЭСКП в высокоспиновых комплексах (б)), чем сильнее стабилизация кристаллическим полем, тем больше гидратация. Известно, что константы замещения молекулы воды на лиганд слабого поля L
[M(H2O)6]2+ + Lx– = [M(H2O)5L](2-x)+ + H2O
подчиняются ряду Ирвинга-Уильямса: Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+ (Рис. 1.34. Зависимость первой константы устойчивости комплекса от природы 3d-металла). Согласно этому ряду, наибольшей устойчивостью обладают комплексы меди(II) и никеля(II). Простейший вариант ЭСКП предсказывает наибольшую устойчивость никелевых комплексов. При этом надо учитывать, что комплексы меди(II) имеют сильно искаженную октаэдрическую геометрию, что вносит существенный вклад в величину константы устойчивости.
Нефелоауксетический эффект. Обнаружено, что взаимное отталкивание d-электронов ослабевает при помещении атома в поле лигандов. Такое воздействие лиганда на d-электроны атома металла получило название нефелоауксетического эффекта от греческих слов νεφελη – облако и αυξανω – увеличивать. Ряд лигандов, расположенных в порядке усиления их воздействия на орбитали металла, практически полностью соответствует спектрохимическому ряду. Причиной нефелоаксетического эффекта служит перекрывание d-орбиталей металла с орбиталями лигандов, благодаря чему d-облако расширяется в пространстве. Наличие этого эффекта наглядно демонстрирует ограниченность простейшей элеткростатической модели – теории критсллического поля, предполагающей, что лигнады являются точечными отрицательными зярядами.
Теория поля лигандов. Теория кристаллического поля была разработана Бете (Bethe) в 1929 г. В настоящее время она находит широкое применение в модифицированном виде с поправками на некоторую долю ковалентности связи металл-лиганд. Такая теория называется теорией поля лигандов. Наличие ковалентного вклада изменяет энергию орбиталей металла по сравнению с рассчитанной по ТКП. Долю ковалентности учитывают введением поправочных коэффициентов, позволяющих приравнять экспериментальные значения к рассчитанным.
Окраска комплексов.
Окраска комплексов d-переходных элементов связана с переходами электронов с одной d-орбитали на другую. Это наглядно иллюстрирует пример иона Ti3+, рассмотренный в первом томе учебника. Поглощая энергию, соответствующую синей и зеленой части видимого спектра, единственный d-электрон в ионе Ti3+ переходит на eg-орбиталь (Рис. 1.35. Спектр иона [Ti(H2O)6]3+). Окраска иона обусловлена дополнительными цветами – красным и фиолетовым. (Сноска – Внимательный читатель заметит некоторую асимметрию полосы поглощения. Она является следствием незначительного расщепления t2g-уровня, вызванного эффектом Яна-Теллера). Диаграмма, на которой изображены дополнительные цвета и которая хорошо известна каждому художнику, представлена на втором форзаце учебника. Энергия перехода, выраженная в обратных сантиметрах (1000 см–1 = 12 кДж), соответствует параметру расщепления Δο – его чаще всего и определяют из электронных спектров. Длина волны обратно пропорциональна энергии:

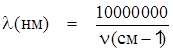 .
.
В случае комплексов с большим числом электронов картина спектра усложняется, в нем появляются дополнительные полосы. Это связано с тем, что возбужденное состояние t2g1eg1 может быть реализовано несколькими способами в зависимости от того, на каких двух d-орбиталях находятся электроны. Например, состояние, при котором электроны занимают dxy и dx2–y2 орбитали, будет выше по энергии, чем состояние dxy1dz21, из-за большего отталкивания электронов по оси x. Энергия, соответствующая полосе с наименьшей энергией, равна параметру расщепления Δo.
Чтобы описать электронные спектры более детально, необходимо ввести некоторые понятия. Любое расположение электронов на подуровне назовем микросостоянием. Число микросостояний N, при которых n электронов занимают х орбиталей, равно
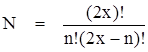
Каждое микросостояние характеризуется собственными значениями спинового и углового моментов. Набор микросостояний с одинаковыми энергиями называется термом, например, 3Р, 5D, 1S. Цифровой индекс обозначает мультиплетность, которая рассчитывается как:
мультиплетность = число неспаренных электронов в основном состоянии + 1.
Названия термов читаются с указанием мультиплетности: “триплет Р”, “квинтет D”, “синглет S”. Буква обозначает суммарный угловой момент L атома или иона, который равен максимальному значению суммы угловых моментов ml отдельных орбиталей, занятых электронами. Например, ион Ti3+ содержит один d-электрон, число микросостояний N = (2´5)!/1!(2´5 – 1)! = 10, L = 2(D) (т.к. для d-орбитали ml = –2, –1, 0, 1, 2, число электронов равно 1, следовательно, максимальная сумма ml равна наибольшему значению ml), мультиплетность 1 + 1 = 2. Следовательно, терм основного состояния (с наименьшей энергией) 2D. В случае иона с электронной конфигурацией d2 N = (2´5)!/2!(2´5 – 2)! = 45, L = 3(F) (т.к. для d-орбитали ml = –2, –1, 0, 1, 2, число электронов равно 2, следовательно, максимальная сумма двух наибольших значений равна ml), мультиплетность 2 + 1 = 3. Следовательно, терм основного микросостояния 3F. При ином расположении двух электронов на d-подуровне достигаются состояния, описываемые другими термами – 3P, 1G, 1D, 1S и т.д. Соотношение между численными значениями L и буквенными символами приведено ниже:
L = 0 1 2 3 4 5 6 7
S P D F G H I K
Аналогично можно вывести термы основных и возбужденных состояний и для других ионов d-элементов (Табл. 1.5.). Обратите внимание, что термы ионов с конфигурацией dn и d10-n совпадают.
Таблица. 1.5.
Термы основного и ближайших возбужденных состояний для различных конфигураций d-электронов.
| Электронная конфигурация | Терм основного состояния | Термы ближайших возбужденных состояний |
| d1, d9 d2, d8 d3, d7 d4, d6 d5 | 2D 3F 4F 5D 6S | 3P, 1G, 1D, 1S 4P, 2H, 2G, 2F 3H, 3G, 3F, 3F 4G, 4F, 4D, 4P |
Термы расщепляются в октаэдрическом поле подобно орбиталям, обозначаемым аналогичными буквами. D термы расщепляются на T2g и Eg составляющие, подобно d-орбиталям, F термы – на T1g, T2g и A2g, подобно f-орбиталям. S и Р термы вообще не расщепляются. Возможности перехода электронов между различными состояниями ограничиваются правилами отбора. Так, в комплексах разрешены лишь переходы между состояниями с одинаковой мультиплетностью. Каждому такому переходу соответствует полоса в спектре поглощения. В качестве примера рассмотрим электронный спектр комплекса [Cr(H2O)6]3+ (Рис. 1.36. Электронный спектр комплекса [Cr(H2O)6]3+). Три полосы обусловлены тремя электронными переходами: 4A2g® 4T2g, 4A2g® 4T1g, 4A2g® 4T1g(P). Переход с наименьшей энергией соответствует величине параметра расщепления: Δo = 17400 см–1. Комплекс поглощает свет в красной (17400 см–1) и голубой (23000 см–1) частях видимого спектра и в ближнем ультрафиолете (37800 см–1), следовательно, он имеет фиолетовую окраску.
Согласно правилу Лапорта, переходы между состояниями с одинаковой четностью, к которым относятся s-s, p-p, d-d, f-f-переходы, маловероятны, или, на языке спектроскопии, в октаэдрических комплексах они запрещены. Запрещенные переходы возможны, но протекают с низкой интенсивностью. Именно поэтому соли переходных металлов имеют заметную окраску лишь в концентрированных растворах. Она во много раз слабее окраски перманганата или дихромата, в ионах которых не содержится d-электронов.
Правило Лапорта применимо лишь в случае комплексов, имеющих центр симметрии. При искажении октаэдра центр симметрии исчезает, запрет Лапорта снимается, и появляется окраска. Например, ион [Fe(H2O)6]3+ бесцветный, однако растворы солей железа(III) часто окрашены в желто-оранжевый цвет из-за гидролиза, приводящего к образованию несимметричных частиц с искаженным октаэдрическим окружением.
Окраску комплексов, помимо d-d переходов с одной d-орбитали металла на другую (с t2g на eg в октаэдрических комплексах), обусловливают еще два фактора: переходы с орбителей лиганда на орбитали металла (их называют переносом заряда) и переходы внутри орбиталей лиганда. Эти переходы не подпадают под правило Лапорта, а, следовательно, имеют высокую интенсивность.
Полоса переноса заряда присутствует в электронном спектре любого соединения, однако, в ряде случаев она находится в ультрафиолетовой части спектра и не воспринимается нами как окраска. Если разность между энергиями орбиталей лиганда и орбиталей металла сокращается, полоса переноса заряда попадает в видимую часть спектра. Именно переносом заряда объясняется интенсивная окраска перманганата, дихромата, сульфида ртути, пероксокомплексов титана(IV) и многих других соединений с пустыми d-орбиталями. В ряде случаев под действием света перенос заряда с орбиталей лиганда на орбитали металла происходит необратимо, то есть сопровождается химическим процессом. Примером служит фотохимическое разложение галогенидов серебра, лежащее в основе черно-белой фотографии: Ag+Br– ¾® Ag0 + Br0.
В электронном спектре перманганата калия наблюдаются четыре полосы, соответствующие переходам электронов с несвязывающих орбиталей, локализованных преимущественно на лиганде (a1, t2 σ-орбитали и e, t1, t2 π-орбитали), на e*, t2’’разрыхляющие орбитали, локализованные на атоме металла ((рис.1.37. Энергетическая диаграмма тетраэдрического иона MnO4- с π-связыванием. Переходы электронов показаны стрелками):
ν1, Mn(e*) ¾ O(t1) 17700 см–1
ν2, Mn(t2’’) ¾ O(t1) 29500 см–1
ν3, Mn(e*) ¾ O(t2) 30300 см–1
ν4, Mn(t2’’) ¾ O(t2) 44400 см–1
Полоса с наименьшей энергией попадает в видимую часть спектра (λ = 107/17700 = 565 нм), что соответствует поглощению зеленого света и пропусканию малиново-красного.
3. Механизмы реакций с участием комплексных соединений.
Подавляющее большинство химических процессов протекает как последовательная цепь некоторых элементарных стадий, а уравнение реакции несет лишь информацию о главных конечных продуктах реакции. Эта последовательность элементарных превращений на пути от исходных веществ к продуктам и называется механизмом. Промежуточные, обычно неустойчивые соединения, через которые пролегает путь от реагентов к продуктам, называют интермедиатами. Любой интермедиатимеет определенное время жизни, обычно крайне непродолжительное, вплоть до 10-14 с. На энергетическом профиле реакции ему отвечает минимум (рис. а) (Рис. 1.38. Энегртеческие профили реакции, протекающей через: (а) интермедиат, (б) переходное состояние.). Как правило, интермедиаты могут быть зафиксированы в реакционной смеси спектральными методами, и лишь в редких случаях их удается выделить в индивидуальном виде. Поэтому главную информацию о механизме реакции обычно получают через изучение ее кинетики – определяя константы скорости и рассчитывая параметры активации (энтальпию, энтропию, объем). В этом случае механизм – это модель, которая находится в соответствии с кинетическими данными, модель, которая может быть улучшена, модифицирована, пересмотрена.
В некоторых реакциях интермедиаты не образуются, а переход от реагентов к продуктам протекает последовательно – один из атомов постепенно удаляется, а другой приближается. В таком случае говорят, что реакция протекает через переходное состояние или активированный комплекс. Ему соответствует максимум на энергетическом профиле реакции (Рис. Б).
Дополнение: Лабильные и инертные комплексы
Термодинамическая устойчивость частицы определяется изменением энергии Гиббса для реакции ее диссоциации, либо значением константы устойчивости этого процесса. Кинетическая устойчивость показывает, насколько быстро данная частица вступает во взаимодействие с другими частицами или претерпевает распад. Химическая частица считается инертной, если она вступает в реакцию с периодом полупревращения более 1 минуты. Частицы, реагирующие с более высокой скоростью, называют лабильными. Необходимо помнить, что кинетическая и термодинамическая устойчивость не зависят одна от другой, то есть одно и то же вещество может иметь высокую константу устойчивости и в то же время быть инертным, или, наоборот, лабильным. Некоторые такие примеры приведены в таблице 1.6.
Таблица 1.6. Константы устойчивости и скорости замещения лигандов в циано-комплексах некоторых металлов.
| Комплекс | Константа устойчивости, 20 °C | Скорость реакции замещения |
| [Ni(CN)4]2- [Hg(CN)4]2- [Fe(CN)6]3- [Fe(CN)6]4- [Pt(CN)4]2- | 1030 1042 1044 1037 1040 | Очень быстрая Очень быстрая Очень медленная Очень медленная t1/2 = 1 мин |
Генри Таубе показал связь кинетической устойчивости октаэдрических комплексов с электронной конфигурацией центрального иона в октаэдрическом поле. Согласно Таубе, лабильными являются комплексы:
· обладающие хотя бы одной вакантной t2g-орбиталью – они могут ее использовать в реакциях по ассоциативному (A, Ia) механизму, либо
· имеющие хотя бы один электрон на eg-орбитали – это способствует реакции по диссоциативному (D, Id) механизму, т.к. удаление электрона с eg-орбитали понижает энергию переходного состояния.
Таким образом, к инертным относятся октаэдрические комплексы хрома(III) (t2g3), низкоспиновые комплексы железа(II) (t2g6) и железа(III) (t2g5), а также комплексы 4d-, 5d-переходных элементов с числом d-электронов больше двух.
КОНЕЦ ДОПОЛНЕНИЯ
Единая классификация неорганических реакций не разработана до сих пор. Условно можно предложить следующую схему (Рис. 1.39. Схема, иллюстрирующая классификацию неорганических реакций):
1) Реакции замещения, присоединения или отщепления лигандов затрагивают изменение координационной сферы металла,
2) Окислительно-восстановительные реакции связаны с изменением электронной конфигурации металла, но не затрагивают его координационное окружение,
3) Реакции координированных лигандов затрагивают изменение лиганда без изменения координационной сферы комплекса.
Реакции замещения. В широком смысле под реакциями замещения понимают процессы замещения одних лигандов в координационной сфере металла другими. Такие реакции могут протекать как с изменением степени окисления, так и без ее изменения. Следуя приведенной выше классификации, мы будем использовать этот термин лишь применительно к реакциям, протекающим без изменения степеней окисления.
Классификация реакций замещения в неорганической химии была разработана Лэнгфордом и Греем. Она основана на определении так называемого предельного механизма, а не на описании конкретного механизма. Первоначально определяют стехиометрический механизм, а затем – внутренний. Стехиометрический механизм – это последовательность элементарных стадий при переходе от исходных веществ к продуктам. Он может быть диссоциативным (D), ассоциативным (A) и обменным (взаимного обмена, I). Диссоциативный и ассоциативный процессы представляют собой как бы два предельных случая, прямо противоположных один другому. Оба процесса протекают в две стадии через образование интермедиата.
Диссоциативный (D)
Процесс двухстадийный, в предельном случае протекает через интермедиат с пониженным КЧ:
ML6 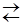 [ML5] + L, [ML5] + Y ¾® ML5Y
[ML5] + L, [ML5] + Y ¾® ML5Y
Ассоциативный (A)
Процесс двухстадийный, характеризуется образованием интермедиата с повышенным КЧ:
ML6 + Y  [ML6Y], [ML6Y] ¾® ML5Y + L
[ML6Y], [ML6Y] ¾® ML5Y + L
Взаимного обмена (I)
По этому механизму протекает большинство реакций обмена. Процесс одностадийный и не сопровождается образованием интермедиата. В переходном состоянии реагент и уходящая группа связаны с реакционным центром, входят в его ближайшую координационную сферу, и в процессе реакции происходит вытеснение одной группы другой, обмен двух лигандов:
ML6 + Y  [L…ML5…Y]
[L…ML5…Y]  ML5Y + L.
ML5Y + L.
Переходное состояние представляет собой либо внешнесферный комплекс, либо, в случае заряженных лигандов, ионную пару MX5L+Y-.
Внутренний механизм (a или d) характеризует процесс замещения лигандов на молекулярном уровне. Он показывает, какой из двух процессов – образование или разрыв связи в переходном состоянии, является лимитирующим. В случае, если скорость реакции определяется образованием связи между реакционным центром и реагентом, говорят об ассоциативной активации. В противном случае, когда лимитирующим фактором служит разрыв связи между реакционным центром и уходящей группой, процесс протекает с диссоциативной активацией. Обращаясь к стехиометрическому механизму, легко заметить, что диссоциативному процессу всегда соответствует диссоциативная активация, ассоциативному – ассоциативная, то есть понятие о внутреннем механизме оказывается информативным лишь в случае механизма взаимного обмена – он может протекать как с диссоциативной (Id), так и с ассоциативной (Ia) активацией. В случае механизма взаимного обмена с ассоциативной активацией (Iа) скорость реакции зависит от природы Y. В переходном состоянии атом металла прочно связан как с уходящей группой, так и с атакующим нуклеофилом. Примером служит процесс замещения атома хлора на бром и иод в комплексе платины с диэтилентриамином (dien):
[PtCl(dien)]+ + Y- ¾¾® [PtY(dien)]+ + Cl-
Y = Br, I скорости сильно различаются.
В случае механизма взаимного обмена с диссоциативной активацией (Id) скорость реакции не зависит от природы реагента Y. Атакующая и уходящая группы в переходном состоянии слабо связаны с центральным ионом. По такому механизму протекает замещение воды на амин в аквакомплексах многих переходных металлов, например, никеля:
[Ni(H2O)6]2+ + Y ¾¾® [Ni(H2O)5Y]2+ + H2O
Y = NH3, py скорости близки.
Исследование механизмов реакций замещения в комплексах многих металлов находится лишь в первоначальной стадии. Исчерпывающая информация получена лишь для плоско-квадратных комплексов платины и октаэдрических комплексов хрома(III) и кобальта(III). Можно считать твердо установленным, что в комплексах платины(II) замещение протекает по ассоциативному механизму (A, Ia) через интермедиат или переходное состояние в форме тригональной бипирамиды. Октаэдрические комплексы кобальта(III) реагируют диссоциативно (D, Id механизмы). Конкретные примеры таких реакций будут рассмотрены при описании химии этих элементов.
Окислительно-восстановительные реакции. Большинство окислительно-восстановительных процессов представляет собой сложную комбинацию отдельных элементарных стадий, на каждой из которых происходит перенос одного или, значительно реже, двух электронов. Одновременный перенос большего числа электронов в растворах невозможен.
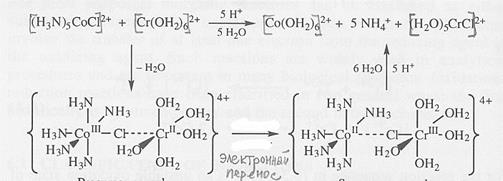
Одноэлектронный перенос может протекать по одному из двух механизмов – внешнесферно, то есть путем туннелирования, либо внутрисферно – через мостиковый лиганд. Внутрисферный механизм реализуется в комплексах, содержащих галогениды, гидроксид-ион, карбоксильные группы, способные выступать в качестве мостиков между металлами. Примером служит реакция между ионами пентамминхлорокобальта(III) и гексааквахрома(II). Процесс можно условно разбить на три стадии – образование гетерометаллического комплекса с мостиковым хлорид-ионом, электронный перенос и распад мостикового комплекса. Образующийся ион [Co(NH3)6]2+, будучи лабильным, мгновенно превращается в аква-комплекс, а инертный [(H2O)5CrCl]2+ не вступает во взаимодействие с водой:
Если в системе нет частиц, которые могли бы выступать в роли мостиковых, процесс протекает внешнесферно:
[Ru(NH3)6]2+ + [Co(phen)3]3+ = [Ru(NH3)6]3+ + [Co(phen)3]2+.
Особо необходимо выделить реакции окислиетльного присоединения и восстановтельного элиминирования, рассмотренные в главе 6.
Реакции координированных лигандов. В данную группу реакций входят процессы модификации лигандов, координированных ионом металла. Так, например, дикетонатные комплексы, подобно свободным дикетонам, можно нитровать, ацилировать, галогенировать. Наиболее интересным и необычным примером реакций координированных лигандов является темплатный синтез – своебразный метод «сборки» лиганда на ионе металла. Примером может служить синтез фталоцианинов из нитрила фталевой кислоты, протекающий в присутствии ионов меди(II), и синтез макроциклического основания Шиффа из 2-аминобензальдегида, протекающий на ионах никеля(II):
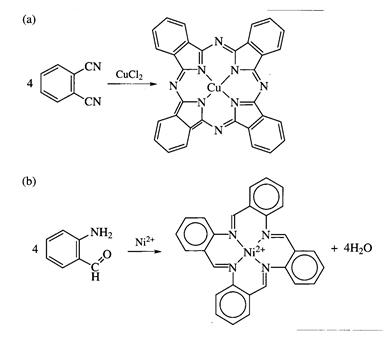
В отсутствии металла процесс протекает по другому пути, и в реакционной смеси желаемый продукт присутствует лишь в незначительном количестве. Ион металла выступает в темплатном синтезе в качестве матрицы («темплата»), стабилизирующей один из продуктов, находящихся в равновесии друг с другом, и смещающей равновесие в сторону его образования. Например, в реакции X + Y ¾® образуется смесь продуктов A и B, в которой преобладает В, имеющий более низкую энергию. В присутствии иона металла в продуктах реакции преобладает вещество А в виде комплекса с М (Рис. 1.40. Энергетическая диаграмма взаимодействия X и Y в отсутствии иона металла (слева) и в его присутствии (б)).
Вопросы и задания
1. Какие из перечисленных ниже соединений имеют структуру перовскита? BaTiO3, LiNbO3, LaCrO3, FeTiO3, Na2WO4, CuLa2O4, La2MgRuO6. Таблица ионных радиусов приведена в Приложении. Имейте в виду, что в сложных оксидных фазах в позициях В могут располагаться катионы двух различных металлов.
2. Воспользовавшись ТКП, определите, прямыми или обращенными будут следующие шпинели: ZnFe2O4, CoFe2O4, Co3O4, Mn3O4, CuRh2O4.
3. Тиоцианат-ион SCN– имеет два донорных центра – жесткий и мягкий. Предположите, какое строение будут иметь тиоцианатные комплексы кальция и меди(I). Почему не удается получить роданид меди(II)?
4. Спектр акваиона Cr2+ (терм основного состояния 5D) имеет две полосы (Рис. 1.41. Спектр акваиона Cr2+), хотя среди термов ближайших возбужденных состояний нет ни одного с такой же мультиплетностью. Чем это объясняется? Какую окраску имеет этот ион?
5. Используя приведенные ниже значения Δο, рассчитайте ЭСКП для следующих комплексов в кДж/моль:
(а) [MnCl6]2– , Δο = 15000 см–1,
(б) [Co(H2O)6]2+ , Δο = 13000 см–1,
(в) [CoCl4]2– , Δο (для [CoCl6]4–)= 21000 см–1,
Энергию спаривания примите равной 19000 см–1, 1кДж/моль = 83 см–1. Рассчитайте их магнитные моменты (спиновую составляющую).
6. Используя ТКП, объясните, почему ион CN– реагирует с ионом гексаакважелеза (III) с образованием гексацианоферрата(II), а с ионом гесаакваникеля(II) с образованием тетрацианоникелата(II).
7. Ниже приведены константы реакций последовательного замещения воды в аквакомплексе меди(II) на аммиак: K1 = 2´104, K2 = 4´103, K3 = 1´103, K4 = 2´102, K5 = 3´10–1, K6 << 1. Чем объясняется трудность вхождения пятой и шестой молекул аммиака в координационную сферу меди?
8. Как изменяется жесткость катионов при движении по 3d-ряду? Согласуется ли это с порядком изменения констант устойчивости комплексов (ряд Ирвинга-Уильямса, рис..1.34 ).
9. Объясните, почему ион гексаакважелеза (III) бесцветный, а растворы солей железа (III) окрашены.
10. Предложите механизм реакции [Fe(CN)6]3– + [Co(CN)5]3– = [Fe(CN)6]4– + [Co(CN)5]2–, если известно, что введение в раствор роданид-иона приводит к изменению скорости реакции, а от присутствия аммиака скорость практически не зависит. Предложите объяснение этим фактам.
Дата добавления: 2016-01-03; просмотров: 7589;
