Соединения элементов IVА группы с кислородом
Оксид углерода II
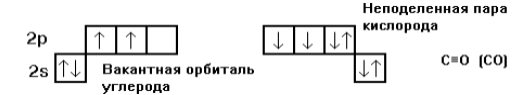
Оксид углерода II - СО часто называют монооксидом углерода или угарным газом. Степень окисления углерода в СО +2, но валентность равна 3. Две ковалентных связи образуются по обменному механизму и одна связь по донорно-акцепторному (свободная орбиталь принадлежит невозбужденному атому углерода, а пара электронов - кислороду).
В небольших количествах оксид углерода II присутствует в атмосфере (от 0,01 до 0,9 мг/м3). СО выделяется при вулканических извержениях, из болот, а также образуется как продукт неполного разложения растительных остатков при лесных пожарах, а также как продукт разложения морских водорослей под действием света. Его также выделяют растения, животные и микроорганизмы. Значительное количество СО поступает в атмосферу в результате технической деятельности человека.
В промышленности СО получают при неполном окислении углерода в соответствии со следующими реакциями: при температурах выше 1000º:
2C + O2 → 2CO
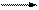 C + H2O(пар) CO + Н2
C + H2O(пар) CO + Н2
C + СO2 → 2CO
Другим промышленным источником СО являются углеводороды:
2CН4 + O2 = 2CO + 4Н2
CН4 + H2O(пар) = CO + 3Н2
В лаборатории СО получают дегидратацией муравьиной кислоты в присутствии водоотнимающих средств, например, концентрированной серной кислоты: НСООН = СО↑ + Н2О
Оксид углерода II – газ без цвета, запаха и вкуса, плохо растворимый в воде. СО – несолеобразующий оксид, несмотря на то, что его получают из муравьиной кислоты и он реагирует со щелочами, образуя соли этой кислоты – формиаты:
CO + NaOH = HCOONa
При повышенной температуре СО – сильный восстановитель. При температурах 500-800ºС он восстанавливает некоторые металлы из оксидов, что используется для их получения:
CuO + CO = Cu + CO2↑
При небольшом нагревании до 150ºС в присутствии катализатора Pt оксид углерода II окисляется хлором с образованием ядовитого газа фосгена:
CO + Cl2 = COCl2
В присутствии катализаторов при комнатной температуре СО окисляется до высшего оксида СО2:
2СО + О2 = 2CO2
Оксид углерода II реагирует с водородом. Подбирая условия: температуру, давление, катализаторы в этих реакциях можно получать разнообразные продукты: предельные углеводороды, спирты, альдегиды, карбоновые кислоты, например:
tº, Ni
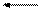
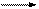 CO + 3H2 CH4 + H2O
CO + 3H2 CH4 + H2O
Большое практическое значение имеет способ получения метилового спирта при 250-300ºС и давлении 5-10 Мпа в присутствии катализаторов по реакции:
СО + 2Н2 = СН3ОН
При температуре 230-280ºС в присутствии Fе2О3 оксид углерода II реагирует с водяным паром:

 СО + H2O(пар) CO2 + Н2
СО + H2O(пар) CO2 + Н2
При повышенных температурах оксид углерода II взаимодействует с аммиаком. При этом продукты этой реакции в зависимости от условий могут быть различны. Так, при температуре около 350º в присутствии платины образуется карбамид или мочевина (NH2)2CO, а при более высокой температуре 500-800ºС с катализаторами Al2O3 и ThO2 получается циановодородная кислота:
СО + 2NH3 = Н2↑ + (NH2)2CO
карбамид
СО + NH3 = НСN + H2O
циановодородная кислота
Оксид углерода IV
Оксид углерода IV СО2 (диоксид углерода, углекислый газ, угольный ангидрид). Молекула СО2 имеет линейное строение (О=С=О) и малополярна. Поэтому диоксид углерода плохо растворим в воде. Он тяжелее воздуха и накапливается в колодцах, погребах, вытесняя кислород и может быть причиной удушения. Сжижается при -75оС или под давлением 50 ат. Если СО2 выпускать из баллона, где он находится под давлением, то образуется сухой лед.
Оксид углерода IV содержится в атмосфере и гидросфере. В воздухе примерно 0,03% объемных СО2. Он является продуктом окисления органических веществ, а также выделяется организмами при дыхании.
В промышленности СО2 получают при сжигании угля, графита и углеводородов в избытке кислорода при температуре от 300 до 700º, а также при обжиге известняка при температуре более 900ºС:
tº
С + O2 = CO2↑
СН4 + 2О2 = CO2↑ + 2Н2О
СаСО3 = СаО + CO2↑
В лаборатории СО2 получают из карбонатов и гидрокарбонатов, действуя на них разбавленными сильными кислотами:
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
СО2 – это бесцветный газ, без запаха, со слабым кисловатым вкусом. Он сжижается при 20ºС и давлении 5,7 МПа. Испарение жидкого СО2 приводит к охлаждению и образованию твердого углекислого газа, называемого «сухим льдом» и имеющего молекулярную кристаллическую решетку. Углекислый газ плохо растворим в воде: при 20ºС в 1л воды растворяется около 900 мл СО2, что объясняется неполярностью молекулы СО2.
Оксид углерода IV – типичный кислотный оксид. Он реагирует с основными оксидами, и сильными основаниями, например:
СО2 + СаО = СаСО3
СО2 + Са(ОН)2 = СаСО3↓ + Н2О
Пропускание СО2 через раствор известковой воды Са(ОН)2 вызывает ее помутнение вследствие образования малорастворимого СаСО3, что является качественной реакцией на углекислый газ. Однако последующее пропускание СО2 приводит к растворению осадка вследствие образования растворимого в воде гидрокарбоната:
СаСО3 + СО2 + Н2О = Са(НСО3)2
гидрокарбонат кальция
При взаимодействии СО2 с водой образуется очень слабая неустойчивая двухосновная угольная кислота:
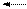
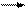 СО2 + Н2О Н2СО3
СО2 + Н2О Н2СО3
Равновесие в этой реакции сильно смещено влево. Из общего числа растворенных молекул СО2 только около 0,6% реагируют с водой.
Оксид углерода (IV) содержит атом углерода в высшей степени окисления +4, поэтому проявляет окислительные свойства, хотя и слабо выраженные. При повышенных температурах от 200 до 1000ºС СО2 восстанавливается активными металлами, углеродом и водородом:
СО2 + 2Mg = C + 2MgO
2СО2 + 5Ca = CaC2 + 4CaO
ацетиленид кальция
 СО2 + 4H2 CH4 + 2H2O
СО2 + 4H2 CH4 + 2H2O

 СО2 + С 2CO
СО2 + С 2CO
В последней реакции при температуре выше 1000º равновесие смещается вправо, а при температуре ниже 400º - влево.
При температуре около 300ºС и высоком давлении 5-10МПа СО2 взаимодействует с аммиаком с образованием мочевины (или карбамида) – ценного удобрения:
2NH3 + CO2 → (NH2)2CO + H2O
К числу специфических свойств СО2 можно отнести его реакцию с пероксидом натрия, протекающую при обычных условиях и сопровождающуюся образованием кислорода:
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Оксид кремния IV
Оксид кремния IV SiO2 (диоксид кремния, кремниевый ангидрид) очень распространен в природе в виде минерала кремнезема, который существует в кристаллическом и аморфном состояниях. Кристаллический SiO2 встречается в виде минерала кварца и его разновидностей (горный хрусталь, яшма, агат, халцедон). Аморфный кремнезем встречается в виде минерала опала, а также в виде кизельгура (инфузорной земли), образовавшегося из остатков панцирей древних инфузорий. Он обладает очень большой удельной поверхностью и исключительной сорбционной способностью.
Получить SiO2 можно при высокой температуре (более 400º) взаимодействием простых веществ:
Si + O2 = SiO2
Это твердое прозрачное тугоплавкое вещество, нерастворяющееся в воде и других растворителях и не обладающее тепло- и электропроводностью.
В кристаллической форме SiO2 образует несколько модификаций, различающихся взаимным расположением кремнекислородных тетраэдров. При определенных температурах (от 573º до 1470ºС) и нормальном давлении осуществляется взаимный переход кристаллических модификаций SiO2, что сопровождается изменением его объема и плотности.
При температуре 1723ºС кристаллический SiO2 плавится. При быстром охлаждении расплава образуется стекловидная масса – плавленый кварц или кварцевое стекло, структура которого характеризуется неупорядоченным расположением кремнекислородных тетраэдров. Несмотря на такое строение кварцевое стекло тугоплавко и химически инертно.
Кристаллический SiO2 химически инертен. Он реагирует при комнатной температуре только с плавиковой кислотой НF:
SiO2 + 6НFконц = Н2[SiF6] + 2H2O
При температуре около 400ºС кристаллический SiO2 взаимодействует с газообразным фтороводородом и фтором:
SiO2 + 4НFгаз = SiF4↑ + 2H2O
SiO2 + 2F2 = SiF4↑ + O2↑
Кристаллический SiO2 не реагирует с водой ни при каких условиях. Аморфная форма SiO2 химически более активна. Так, при очень высоком давлении и температуре около 150ºС она медленно растворяется в воде, образуя ортокремниевую кислоту:
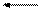
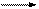 SiO2 + 2H2O Н4SiO4
SiO2 + 2H2O Н4SiO4
Кристаллический SiO2, как типичный кислотный оксид, при сплавлении реагирует со щелочами, основными оксидами и с некоторыми солями, например:
SiO2 + 2NaOH = Na2SiO3 + H2O
силикат натрия
SiO2 + FeO = FeSiO3
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Аморфный SiO2 медленно реагирует с концентрированными щелочами и карбонатами щелочных металлов (при комнатной температуре), образуя соли ортокремневой кислоты:
SiO2 + 4NaОНконц = Na4SiO4 + 2H2O
SiO2 + 2NaСО3 конц = Na4SiO4 + 2СO2
При сплавлении кристаллического SiO2 с углем в электрических печах при температуре 1300ºС образуется SiС карборунд, одно из самых твердых веществ: SiO2 + 2C = SiС + CO2↑
При температуре выше 1100ºС SiO2 восстанавливается кремнием с образованием неустойчивого при комнатной температуре оксида кремния II SiO – коричневого твердого вещества

 SiO2 + Si 2SiO
SiO2 + Si 2SiO
Дата добавления: 2015-12-29; просмотров: 1423;
