Конструирование рекомбинантных
Молекул ДНК
Непосредственное конструирование рекомбинантных молекул ДНК следует после того, как получены рестрикты исследуемой ДНК и векторной ДНК. Оно заключается в смыкании сегментов-рест-риктов исследуемой ДНК с рестриктом векторной ДНК, которая в результате рестрикции превращается из кольцевой в линейную ДНК.
Чтобы сомкнуть фрагменты исследуемой ДНК с ДНК-вектора, используют ДНК-лигазу (рис. 227). Лигирование будет успешным, если смыкаемые структуры обладают 3'-гидроксил и 5'-фосфатной группами и если эти группы расположены соответствующим образом 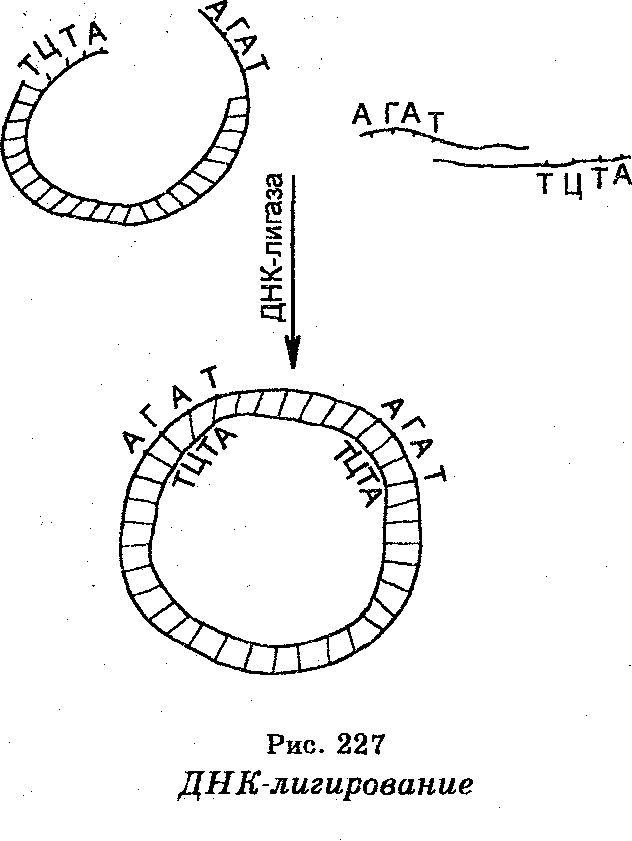 одна относительно другой. Фрагменты объединяются через их «липкие» концы в результате са-мокомплементарности. При высоких концентрациях фрагментов последние время от времени становятся в правильное положение (напротив друг друга). Многие ре-стриктазы, такие как Eco R I, продуцируют «липкие» концы, состоящие из 4-х оснований. Процесс лигирования «липких» концов, состоящих из четырех оснований, происходит при пониженной температуре (до 12°С).
одна относительно другой. Фрагменты объединяются через их «липкие» концы в результате са-мокомплементарности. При высоких концентрациях фрагментов последние время от времени становятся в правильное положение (напротив друг друга). Многие ре-стриктазы, такие как Eco R I, продуцируют «липкие» концы, состоящие из 4-х оснований. Процесс лигирования «липких» концов, состоящих из четырех оснований, происходит при пониженной температуре (до 12°С).
Если при рестрикции образуются фрагменты без «липких» концов, то их «насильственно» конвертируют в молекулы с
«липкими» концами, используя фермент трансферазу. Этот фермент добавляет нуклеотиды к 3'-концу ДНК. На одном фрагменте может быть добавлен поли-А-хвост, на другом — поли-Т-хвост. Для генерации любых желаемых концов ДНК используют также так называемую полимеразную цепную реакцию (ПНР). Принцип ПЦР основан на денатурации выделенной из клеток ДНК и «отжиге» ее с добавлением к ренатурирующимся цепям ДНК-олигонуклеотидов, состоящих из 15—20 нуклеотидов каждый. Эти олигонуклеотиды должны быть комплементарны последовательностям в целях, разделенных расстояниями в 50-2000 нуклеотидов. Будучи «затравкой» для синтеза ДНК in vitro, они позволяют ДНК-полимеразе копировать те участки, которые находятся между «затравками». Это копирование дает большое количество копий изучаемого фрагмента ДНК.
Введение рекомбинатных молекуд
ДНК в клетки
После смыкания интересующего фрагмента ДНК (гена) с генетическим вектором с помощью ДНК-лигазы образованные реком-бинантные молекулы вводят в клетки с целью добиться их репликации (за счет генетического вектора) и увеличения количества копий. Наиболее популярным способом введения в клетки рекомбинантных молекул ДНК, в которых вектором служит плазмида, является трансформация Е. coli. С этой целью бактериальные клетки предварительно обрабатывают кальцием или рубидием (ионами) для того, чтобы они стали «компетентными» в восприятии рекомби-нантной ДНК.
Чтобы повысить частоту проникновения ДНК в клетки, используют метод электропорации, заключающийся в кратком экспонировании клеток в интенсивном электрическом поле. Эта обработка создает полости в мембранах клеток, что способствует лучшему восприятию клетками ДНК- После введения рекомбинантных молекул ДНК в бактерии последние высевают на МПА, обогащенный антибиотиками для селекции желаемых клеток, т. е. клеток, содержащих рекомбинантные молекулы ДНК. Частота трансформации является невысокой. Обычно один трансформант возникает на 106 высеянных клеток. Если же вектор является фаговым, то прибегают к трансфекции клеток (бактерий или дрожжей) фагом. Что касается соматических клеток животных, то их трансфекцию осуществляют ДНК в присутствии химических веществ, облегчающих прохождение ДНК через плазматические мембраны. Возможны также прямые микроинъекции ДНК в овоциты лягушек, в культивируемые соматические клетки и в эмбрионы млекопитающих.
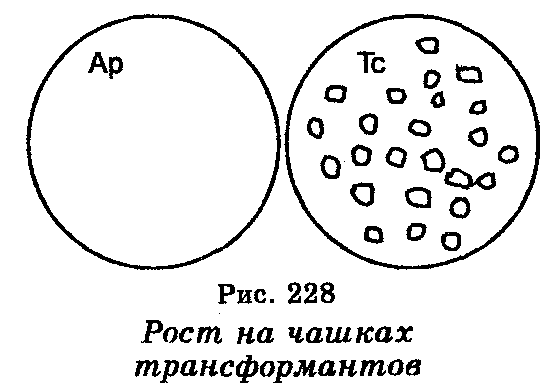 Важнейшим моментом, связанным с молекулярным клониро-ванием, является поиск способа, позволяющего установить, действительно ли клонируемый фрагмент включился в вектор и вместе с вектором, образовав рекомбинантную молекулу ДНК, вошел в клетки. Если речь идет о бактериальных клетках, то один из способов основан на учете инсерционной инактивации плазмидного (векторного) гена резистентности. Например, в плазмидном векторе pBR322, детерминирующем резистентность к ампициллину и тетрациклину, единственный сайт для рестриктазы Pst I находится в локусе, занимаемом геном резистентности к ампициллину. Pst I —плавление на этом сайте генерирует липкие концы, позволяющие лигирование клонируемого фрагмента с векторной ДНК. Однако при этом плазмидный (векторный) ген ампициллинрезис-тентности инактивируется, тогда как ген тетрациклинрезистентнос-ти на векторе остается интактным. Именно, ген тетрациклинрезис-тентности и используется для селекции клеток, трансформируемых рекомбинантными молекулами ДНК. Чтобы убедиться, что клетки выросших колоний на среде с тетрациклином действительно содержат рекомбинантные молекулы ДНК, их проверяют с помощью так называемого «спот-теста» на паре чашек с плотной средой, одна их которых содержит ам-пициллин, тогда как другая лишена этого антибиотика. Клонируемые ДНК содержатся лишь в трансформантах, резистентных к тетрациклину (рис. 228). Что касается трансформантов, резистентных одновременно к ампициллину и тетрациклину (АрТс), то они содержат плазмидные (векторные) молекулы, которые спонтанно приобрели кольцевую форму без включения в них чужеродной (клонируемой) ДНК. Другой способ обнаружения инсерции чужеродных (клонируемых) фрагментов в плазмидный вектор основан на использовании вектора, содержащего ген (3-га-лактозидазы. Инсерция чужеродной ДНК в этот ген неизбежно инак-тивирует синтез р-галактозидаза, что может быть обнаружено посевом трансформированных клеток на среду, которая содержит субстраты р-галактозидазы. Эта среда позволяет селекцию окрашенных колоний клеток.
Важнейшим моментом, связанным с молекулярным клониро-ванием, является поиск способа, позволяющего установить, действительно ли клонируемый фрагмент включился в вектор и вместе с вектором, образовав рекомбинантную молекулу ДНК, вошел в клетки. Если речь идет о бактериальных клетках, то один из способов основан на учете инсерционной инактивации плазмидного (векторного) гена резистентности. Например, в плазмидном векторе pBR322, детерминирующем резистентность к ампициллину и тетрациклину, единственный сайт для рестриктазы Pst I находится в локусе, занимаемом геном резистентности к ампициллину. Pst I —плавление на этом сайте генерирует липкие концы, позволяющие лигирование клонируемого фрагмента с векторной ДНК. Однако при этом плазмидный (векторный) ген ампициллинрезис-тентности инактивируется, тогда как ген тетрациклинрезистентнос-ти на векторе остается интактным. Именно, ген тетрациклинрезис-тентности и используется для селекции клеток, трансформируемых рекомбинантными молекулами ДНК. Чтобы убедиться, что клетки выросших колоний на среде с тетрациклином действительно содержат рекомбинантные молекулы ДНК, их проверяют с помощью так называемого «спот-теста» на паре чашек с плотной средой, одна их которых содержит ам-пициллин, тогда как другая лишена этого антибиотика. Клонируемые ДНК содержатся лишь в трансформантах, резистентных к тетрациклину (рис. 228). Что касается трансформантов, резистентных одновременно к ампициллину и тетрациклину (АрТс), то они содержат плазмидные (векторные) молекулы, которые спонтанно приобрели кольцевую форму без включения в них чужеродной (клонируемой) ДНК. Другой способ обнаружения инсерции чужеродных (клонируемых) фрагментов в плазмидный вектор основан на использовании вектора, содержащего ген (3-га-лактозидазы. Инсерция чужеродной ДНК в этот ген неизбежно инак-тивирует синтез р-галактозидаза, что может быть обнаружено посевом трансформированных клеток на среду, которая содержит субстраты р-галактозидазы. Эта среда позволяет селекцию окрашенных колоний клеток.
Как уже отмечено, рестрикционные линейные фрагменты векторной ДНК способны к восстановлению кольцевой структуры без включения в них клонируемых сегментов. Чтобы уменьшить частоту спонтанного образования таких кольцевых молекул векторной ДНК, рестрикты векторной ДНК обрабатывают фосфатазой. В результате этого образование кольцевых молекул ДНК становится невозможным, поскольку будут отсутствовать концы 5'-РО^, необходимые для действия лигазы.
Совокупность колоций-трансформантов, выросших на селективной среде, представляет собой совокупность клеток, содержащих клоны разных фрагментов (генов) клонируемой геномной или кДНК. Коллекции этих клонов формируют так называемые библиотеки ДНК, широко используемые в генно-инженерных работах.
Заключительной стадией клонирования генов является выделение и исследование клонированной ДНК, включая секвениро-вание.
Перспективные штаммы бактерий или соматических клеток, содержащих рекомбинантные молекулы ДНК, которые контролируют синтез интересующих белков, имеющих коммерческую ценность, передают в промышленность.
Вопросы для обсуждения
1. Что понимают под генной, клеточной и генетической инженерией? Есть ли разница между этими понятиями и понятием о молекулярном клонировании?
2. В чем заключается прогрессивность генетической инженерии по сравнению с другими методами, используемыми в биологии?
3. Перечислите основные «инструменты» генной инженерии.
4. Что представляют собой ферменты-рестриктазы, каковы их свойства и какова их роль в генной инженерии?
5. Все ли рестриктазы образуют «липкие» концы исследуемой ДНК и зависит ли структура «липких» концов от вида рестриктазы?
6. Дайте определение генетическим векторам. Существуют ли природные векторы?
7. Как получают генетические векторы в лабораторных условиях? Какие биологические объекты являются исходным материалом для получения векторов?
8. Какова предельная длина последовательностей азотистых оснований ДНК, которые еще могут включиться в генетический вектор? Различаются ли векторы по «мощности»?
9. Охарактеризуйте свойства ДНК-лигазы и определите ее роль в генной инженерии.
10. Как смыкают клонируемый сегмент ДНК (ген) с генетическим вектором?
11. Какова частота введения рекомбинантных молекул ДНК в бактериальные клетки?
12. На каком принципе основана селекция бактериальных клеток, содерасащих рекомбинантные молекулы ДНК? Приведите один из примеров такой селекции.
13. Можно ли считать штамм Е. coli, содержащий ген инсулина человека, новым видом бактерий?
14. Многие штаммы бактерий обладают одинаковыми ферментами, практически одинаково обеспечивающими их метаболизм. Между тем нуклеотидная специфичность систем рестрикции-модификации бактерий различна. Можете ли вы объяснить это явление?
15. Почему последовательности ДНК, представляющие собой сайты распознания рестриктазами, не могут содержать более восьми пар оснований?
16. Сколько раз последовательность ГГЦЦ, распознаваемая рестриктазой Нае III, будет встречаться в сегменте ДНК длиной в 50 000 пар оснований с 30%-, 50%- и 70%-процентным содержанием ГЦ?
17. Рестриктазы Ват Н I и Bgl I плавят последовательности Г-ГАТЦЦ и Т-ГАТЦА, соответственно. Можно ли включить в сайты Barn H I фрагменты ДНК, продуцированные Bgl 1-рестрикцией? Если да, то почему? Если используемая плазмида (вектор) содержит один сайт для рестрикции Barn H I, то на какой питательной среде можно осуществить селекцию бактерий, содержащих эту плазмиду?
18. Вычислите частоту трансформации бактерий на одну молекулу ДНК, если на 6000 плаамидных пар оснований образуется б х 106 трансформантов?
19. Можно ли клонировать 0-пункт репликации ДНК Е. coli и если да, то каким образом?
20. Можно ли определить, сколько необходимо молекул ДНК для трансформации одной клетки Е. coli?
21. Можно ли с помощью полимеразной цепной реакции определить сайт сплайсинга на мРНК?
22. Каким образом можно использовать полимеразную цепную реакцию для того, чтобы ввести желаемый сайт рестрикции в интересующее место на фрагменте ДНК, предназначенном для клонирования?
Литература
Альберте В., Брей Д., Льюис Дж.. Рэфф М., Роберте К., Уотсон Дж. Молекулярная биология клетки. М.: Мир. 3.984. Т. 1. 615 стр.
Маниатж Т., Фрич Э„ Сзмбрук Дж, Молекулярное клонирование. М.: Мир. 1984. 479 стр.
Пехов А. П. Основы плазмидологии. М.: РУДН. 1996. 229 стр. Hunter Ceuera J„ Belt A. Maintaining Cultures for Biotechnology and Industry. Academic Press. 1995. 242 pp.
Kaplitt M; Loewy A. Viral Vectors. Academic Press. 1995. 486 pp. Russo E., Cove D. Genetic Engineering. WH Preeman. 1995. 255 pp.
Глава XX
Дата добавления: 2015-12-29; просмотров: 922;
