Гистогенез и органогенез
Развитие (дифференцировка) зародышевых листков в ходе эмбриогенеза сопровождается тем, что из них формируются различные ткани и органы. В частности, из эктодермы развиваются эпидермис кожи, ногти и волосы, сальные и потовые железы, нервная система (головной мозг, спинной мозг, ганглии, нервы), рецептор-ные клетки органов чувств, хрусталик глаза, эпителий рта, носовой полости и анального отверстия, зубная эмаль. Из энтодермы развиваются эпителий пищевода, желудка, кишек, желчного пузыря, трахеи, бронхов, легких, мочеиспускательного канала, а также печень, поджелудочная железа, щитовидная, паращитовидная и зобная железы. Из мезодермы развиваются гладкая мускулатура, скелетные и сердечные мышцы, дерма, соединительная ткань, кости и хрящи, дентин зубов, кровь и кровеносные сосуды, брыжейка, почки, семенники и яичники. У человека первыми обособляются головной и спинной мозг. Через 26 дней после овуляции длина человеческого зародыша составляет около 3,5 мм. При этом уже видны зачатки рук, но зачатки ног только вступают в развитие. Через 30 дней после овуляции длина зародыша равна уже 7,5 мм. В это время уже можно различить сегментацию зачатков конечностей, глазные бокалы, полушария головного мозга, печень, Желчный пузырь и даже разделение сердца на камеры.
У восьминедельного зародыша человека при длине его около 40 мм и весе около 5 г появляются почти все структуры тела. Органогенез заканчивается к концу эмбрионального периода. В это время эмбрион по внешнему виду приобретает черты сходства с человеком.
Длина 12 недельного человеческого плода составляет уже около 87 мм, а масса около 45 г. Продолжается дальнейший рост и развитие плода. Например, на 4-м месяце развития появляются волосы, а на 20-й неделе начинают образовываться клетки крови.
Если дефинитивное ротовое отверстие образуется на месте первичного рта (бластопора), то этих животных называют первичноро-тыми (черви, моллюски, членистоногие). Если же дефинитивный рот образуется в противоположном месте, то этих животных называют вторичноротыми (иглокожие, хордовые).
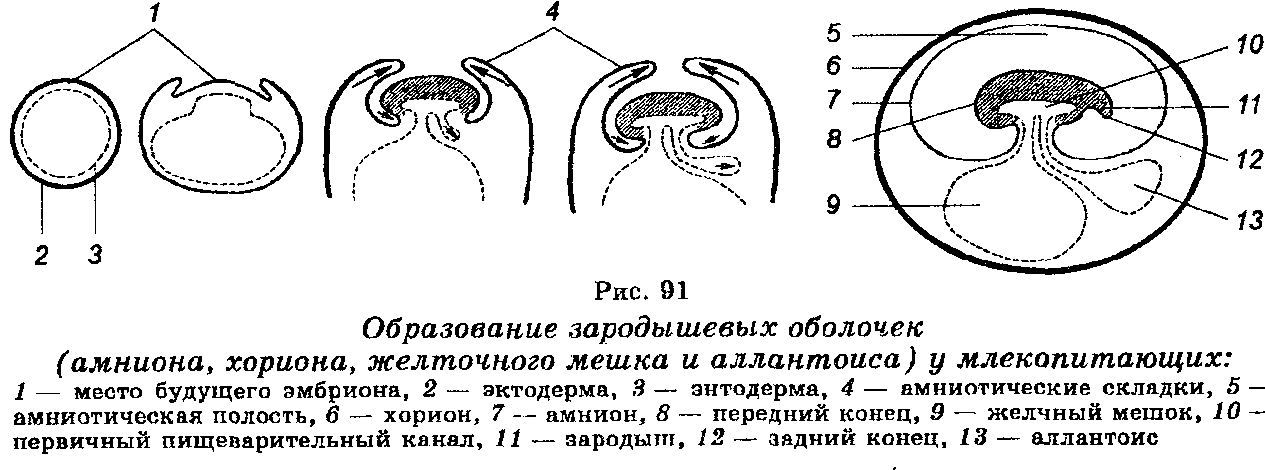
Для обеспечения связи зародыша со средой у него развиваются так называемые провизорные органы, которые существуют временно. В зависимости от типа яйцеклеток провизорными органами являются разные структуры. У рыб, рептилий и птиц провизорным органом является желточный мешок. У млекопитающих желточный мешок закладывается в начале эмбриогенеза, но не развивается. Позднее он редуцируется. В ходе эволюции у рептилий, птиц и млекопитающих развились зародышевые оболочки, обеспечивающие защиту и питание эмбрионов (рис. 91). У млекопитающих, в т. ч. у человека, эти зародышевые оболочки являются листками ткани, развивающимися из тела эмбриона. Существуют три такие оболочки — амнион, хорион и аллантоис. Наружная оболочка эмбриона называется хорионом. Она врастает в матку. Место наибольшего врастания в матку называется плацентой. Зародыш с плацентой связан через пуповину или пупочный канатик, в котором имеются кровеносные сосуды, обеспечивающие плацентарное кровообращение. Амнион развивается из внутреннего листка, а аллантоис развивается между амнионом и хорионом. В пространстве между эмбрионом и амнионом, которое называется амниоти-ческой полостью, содержится жидкость (амниотическая). В этой жидкости находится эмбрион, а затем и плод до самого рождения. Метаболизм плода обеспечивается через плаценту.
В основе формообразующего взаимодействия частей эмбриона лежат определенным образом скоординированные процессы обмена веществ. Закономерностью развития является гетерохронность, под которой понимают разное во времени образование закладок органов и разную интенсивность их развития. Быстрее развиваются те органы и системы, которые должны раньше начать функционировать. Например, у человека зачатки верхних конечностей развиваются быстрее, чем зачатки нижних.
Большое влияние на развитие зародыша и плода оказывают условия жизни матери. Зародыш чрезвычайно чувствителен к разным воздействиям. Поэтому различают так называемые критические периоды, т. е. периоды, в которых зародыши, а потом и плоды наиболее чувствительны к повреждающим факторам. В случае человека критическими периодами эмбрионального онтогенеза являются первые дни после оплодотворения, время образования плаценты и роды, а повреждающими факторами являются алкоголь, токсические вещества, недостаток кислорода, вирусы, бактерии, патогенные простейшие, гельминты и другие факторы. Эти факторы обладают терратогенным действием и ведут к уродствам, нарушениям нормального развития.
 Еще со времен Гиппократа (V в. д. н. э.) обсуждается вопрос о причинах, которые инициируют рождение плода. В частности, сам Гиппократ предполагал, что развитие плода инициирует собственное рождение. Новейшие экспериментальные работы английских исследователей, выполненные на овцах, показали, что у овец инициация окотов контролируется комплексом гипоталамус + гипофиз + надпочечники плодов. Повреждения ядер гипоталамуса, удаление передней доли гипофиза или надпочечников пролонгирует беременности овец. Напротив, введение овцам аденокортикотроп-ного гормона (секрета передней доли гипофиза) или кортизола (секрета надпочечников) сокращает сроки их беременностей.
Еще со времен Гиппократа (V в. д. н. э.) обсуждается вопрос о причинах, которые инициируют рождение плода. В частности, сам Гиппократ предполагал, что развитие плода инициирует собственное рождение. Новейшие экспериментальные работы английских исследователей, выполненные на овцах, показали, что у овец инициация окотов контролируется комплексом гипоталамус + гипофиз + надпочечники плодов. Повреждения ядер гипоталамуса, удаление передней доли гипофиза или надпочечников пролонгирует беременности овец. Напротив, введение овцам аденокортикотроп-ного гормона (секрета передней доли гипофиза) или кортизола (секрета надпочечников) сокращает сроки их беременностей.
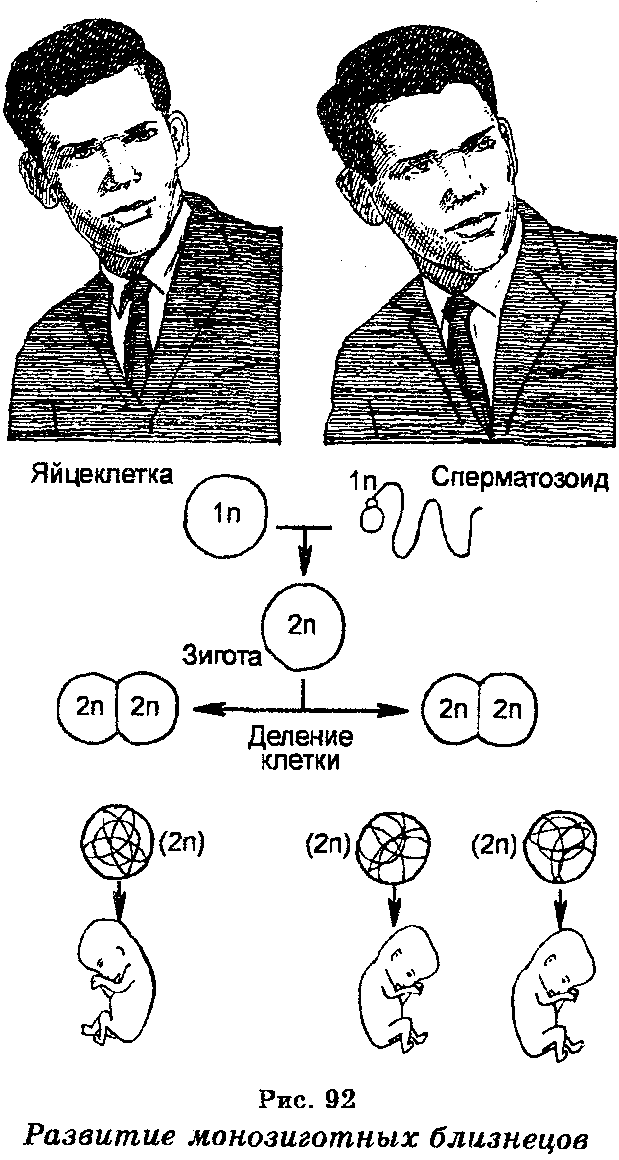
Довольно частым нарушением развития является разделение зародыша на очень ранней стадии развития, что сопровождается развитием однояйцевых (моно-зиготных) близнецов (рис. 92). Известны также и так называемые сиамские близнецы, представляющие собой неразделенные организмы. Неразделенность встречается разной — от незначительного соединения до почти полного слияния двух организмов с разделенными головами или ногами. Иногда из двух сиамских близнецов один нормален, но другой чрезвычайно изменен, будучи прикрепленным к нормальному, являясь, по существу, паразитом.
 Итак, в процессе развития высших эукариотов одиночная оплодотворенная клетка-зигота в ходе дальнейшего развития в результате митоза дает начало клеткам разных типов — эпителиальным, нервным, костным, клеткам крови и другим, которые характеризуются разнообразием морфологии и макромолекулярного состава. Однако для клеток разных типов характерно и то, что они содержат одинаковые наборы генов, но являются высокоспециализированными, выполняя лишь одну или несколько специфических функций, т. е. одни гены «работают» в клетках, другие неактивны. Например, только эритроциты специфичны в синтезе и хранении гемоглобина.
Итак, в процессе развития высших эукариотов одиночная оплодотворенная клетка-зигота в ходе дальнейшего развития в результате митоза дает начало клеткам разных типов — эпителиальным, нервным, костным, клеткам крови и другим, которые характеризуются разнообразием морфологии и макромолекулярного состава. Однако для клеток разных типов характерно и то, что они содержат одинаковые наборы генов, но являются высокоспециализированными, выполняя лишь одну или несколько специфических функций, т. е. одни гены «работают» в клетках, другие неактивны. Например, только эритроциты специфичны в синтезе и хранении гемоглобина.
Точно так лишь клетки эпидермиса синтезируют кератин. Поэтому давно возникли вопросы о генетической идентичности ядер соматических клеток и о контрольных механизмах развития оплодотворенных яйцеклеток как пререквизита в познании механизмов, лежащих в основе дифференцировки клеток.
Начиная с 50-х годов во многих лабораториях были выполнены эксперименты по успешной пересадке ядер соматических клеток в яйцеклетки, искусственно лишенные собственных ядер. Исследование ДНК из ядер разных дифференцированных клеток показало, что почти во всех случаях геномы содержат одинаковые наборы последовательностей нуклеотидных пар. Известны лишь исключения, когда эритроциты млекопитающих теряют свои ядра в течение последней стадии дифференцировки. Но к этому времени пулы стойких гемоглобиновых мРНК уже синтезированы, так что ядра больше не нужны эритроцитам. Другими примерами служат гены иммуноглобулинов и Т-клеток, модифицируемые в ходе развития.
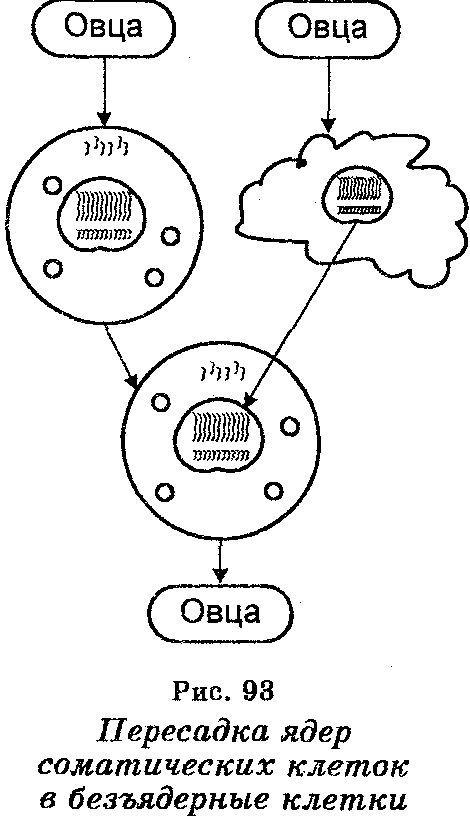
Одним из крупных этапов в направлении познания контрольных механизмов эмбрионального онтогенеза стали результаты экспериментов, выполненных в 1960—70 гг. английским исследователем Д. Гёрдоном с целью выяснить, обладают ли ядра соматических клеток способностью обеспечивать дальнейшее развитие яйцеклеток, если эти ядра ввести в яйцеклетки, из которых предварительно удалены собственные ядра. На рис. 93 приведена схема одного из этих экспериментов, в котором ядра соматических клеток головастика пересаживали в яйцеклетки лягушки с предварительно удаленными ядрами. Эти эксперименты показали, что ядра соматических клеток действительно способны обеспечивать дальнейшее развитие яйцеклеток, т. к. они оказались способными оплодотворять яйцеклетки и «заставляли» их развиваться дальше. Этим была показана возможность клонирования животных.
Позднее другими исследователями были выполнены эксперименты, в которых было показано, что перенос отдельных бластомеров из 8- и 16-дневных эмбрионов овец одной породы в безъядерную половину яйцеклетки (после рассечения последней пополам) другой породы сопровождалось формированием жизнеспособных эмбрионов с последующим рождением ягнят.
В начале 1997 г. английскими авторами было показано, что введение в искусственно лишенные ядра яйцеклеток овец ядер соматических клеток (клеток эмбрионов, плодов и вымени взрослых овец), а затем имплантация оплодотворенных таким образом яйцеклеток в матку овец сопровождается возникновением беременности с последующим рождением ягнят.
Оценка этих результатов показывает, что млекопитающих можно размножать асексуальным путем, получая потомство животных, клетки которых содержат ядерный материал отцовского или материнского происхождения в зависимости от пола овцы-донора, в таких клетках лишь цитоплазма и митохондрии имеют материнское происхождение. Это заключение имеет чрезвычайно важное общебиологическое значение, расширяет наши взгляды на потенциал размножения животных. Но важно также добавить, что речь идет о генетических манипуляциях, которые в природе отсутствуют. С другой стороны, в практическом плане эти генетические манипуляции представляют собой прямой путь клонирования высокоорганизованных животных с заданными свойствами, что имеет важное экономическое значение (см. раздел VI). В медицинском плане этот путь, возможно, будет использован в будущем для преодоления мужского бесплодия.
Итак, генетическая информация, необходимая для нормального развития эмбриона, не теряется в течение дифференцировки клеток. Другими словами, соматические клетки обладают свойством, получившим название тотипотентности, т. е. в их геноме содержится вся информация, полученная ими от оплодотворенной яйцеклетки, давшей им начало в результате дифференциации. Наличие этих данных с несомненностью означает, что дифференциация клеток подвержена генетическому контролю.
Установлено, что интенсивный белковый синтез, следующий за оплодотворением, у большинства эукариотов не сопровождается синтезом мРНК. Изучение овогенеза у позвоночных, в частности У амфибий, показало, что интенсивная транскрипция происходит еще в течение профазы I (особенно диплотены) мейоза. Поэтому генные транскрипты в форме молекул мРНК или про-мРНК сохраняются в яйцеклетках в бездействующем состоянии. Установлено, что у эмбриональных клеток имеет место так называемое ассимет-ричное деление, заключающееся в том, что деление эмбриональной клетки дает начало двум клеткам, из которых лишь одна наследует белки, принимающие участие в транскрипции. Таким образом, неравное распределение транскрипционных факторов между дочерними клетками ведет к экспрессии в них разных наборов генов после деления, т. е. к дифференциации клеток.
У амфибий и, возможно, у большинства позвоночных, генетические программы, контролирующие раннее развитие (до стадии бластулы), устанавливается еще в течение овогенеза. Более поздние стадии развития, когда начинается клеточная дифференциация (примерно со стадии гаструлы) нуждаются в новых программах для экспрессии генов. Таким образом, дифференцировка клеток связана с перепрограммированием генетической информации в том или ином направлении.
Характерная особенность дифференцировки клеток заключается в том, что она необратимо ведет к тому или иному типу клеток. Этот процесс носит название детерминации и также находится под генетическим контролем, а как сейчас предполагают, дифференциация и детерминация клеток регулируется взаимодействием клеток на основе сигналов, осуществляемых пептидными ростовыми факторами через тирозинкиназные рецепторы. Вероятно, существует много таких систем. Одна из них заключается в том, что дифференциация мышечных и нервных клеток регулируется нейрорегу-линами, представляющими собой мембранные белки, действующие через один или более тирозинкиназных рецепторов.
Генетический контроль детерминации демонстрируется также существованием так называемых гомейотропных или гомеозисных мутаций, которые, как показано у насекомых, вызывают изменения при детерминации в специфических имагинальных дисках. В результате некоторые части тела развиваются не на своих местах. Например, у дрозофил мутации трансформируют детерминацию антенного диска в диск, который развивается в аппендикс конечности, протянутой от головы. У насекомых из рода Ophthalmoptera структуры крыльев могут развиваться из диска для глаз. У мышей показано существование генного кластера (комплекса) Нох, который состоит из 38 генов и контролирует развитие конечностей.
Самостоятельное значение имеет вопрос о регуляции активности генов в период эмбрионального развития. Считают, что в ходе дифференцировки гены действуют в разное время, что выражается в транскрипции в разных дифференцированных клетках разных мРНК, т. е. имеет место репрессия и дерепрессия генов. Например, количество генов, транскрибируемых в РНК в бластоцитах морского ежа, равно 10% , в клетках печени крыс — тоже 10% , а в клетках тимуса крупного рогатого скота — 15%. Предполагают, что в контроле транскрипционного статуса генов принимают участие негистоновые белки. В пользу этого предположения свидетельствуют следующие данные. Когда хроматин клеток в фазе транскрибируется в системе in vitro, то синтезируется только гистоновая мРНК, а вслед за нею и гистоны. Напротив, когда используют хроматин клеток из О^-фазы, то никакой гистоновой мРНК не синтезируется. Когда же негистоновые белки удаляются из хроматина G1-фазы и замещаются негис-тоновыми хромосомными белками, синтезированными в фазе S, то после транскрипции такого хроматина in vitro синтезируется гистоновая мРНК. Больше того, когда негистоновые белки происходят из G^-фазы клеток, а ДНК и гистоны из S-фазы клеток, никакой гистоновой мРНК не синтезируется. Эти результаты показывают, что содержащиеся в хроматине негистоновые белки определяют возможность транскрипции генов, кодирующих гистоны. Поэтому считают, что негистоновые хромосомные белки могут играть важную роль в регуляции и экспрессии генов у эукариот.
Имеющиеся данные позволяют считать, что в регуляции транскрипции у животных принимают участие белковые и стероидные гормоны. Белковый (инсулин) и стероидные (эстрогон и тестосте-рон) гормоны представляют собой две сигнальные системы, используемые в межклеточных коммуникациях. У высших животных гормоны синтезируются в специализированных секреторных клетках. Освобождаясь в кровяное русло, они поступают в ткани, поскольку молекулы белковых гормонов имеют относительно крупные размеры, то они не проникают в клетки. Поэтому их эффекты обеспечиваются белками-рецепторами, локализованными в мембранах клеток-мишеней, и внутриклеточными уровнями циклического АМФ (цАМФ). Напротив, стероидные гормоны являются малыми молекулами, вследствие чего легко проникают в клетки через мембраны. Оказавшись внутри клеток, они связываются со специфическими рецепторными белками, которые имеются в цитоплазме только клеток-мишеней. Как считают, комплексы гормон + белковый рецептор, концентрируясь в ядрах клеток-мишеней, активирует транскрипцию специфических генов через взаимодействие с определенными негистоновыми белками, которые связываются с промоторными районами специфических генов. Следовательно, связывание комплекса гормон + белок (белковый рецептор) с негистоновыми белками освобождает промоторные районы для движения РНК-полимеразы. Обобщая данные о генетическом контроле эмбрионального периода в онтогенезе организмов, можно заключить, что его ход контролируется дифференциальным включением и выключением действия генов в разных клетках (тканях) путем их дерепрессии и репрессии.
Дата добавления: 2015-12-29; просмотров: 1687;
