Йонообмінна хроматографія
Йонообмінна хроматографія заснована на обміні між йонами, що знаходяться в розчині, та йонами, які входять до складу йонообмінника – іоніту. Розділення суміші йонів, що є в досліджуваному розчині, ґрунтується на неоднаковій здатності їх до обміну з йонами іоніту.
Іоніти можуть бути мінерального і органічного походження. Найбільш широко застосовуються іоніти, що являють собою синтетичні високомолекулярні полімерні матеріали тримірної структури, у просторовій сітці яких закріплені активні групи, здатні до обміну йонів. В іонітах розрізняють каркас або матрицю, яка являє собою неправильну високополімерну просторову сітку карбонових ланцюгів з „пришитими” йонообмінними групами або фіксованими йонами. Властивості йонообмінних синтетичних смол визначаються числом і типом фіксованих йонів, а також будовою матриці, перш за все кількістю поперечних зв’язків у ній. Будова матриці визначає ступінь набухання, а значить і швидкість йонного обміну. Обмін йонів відбувається не тільки на поверхні зерен іоніту, але і в усьому об’ємі зерна.
Йонообмінні смоли отримують полімеризацією чи поліконденсацією більш простих речовин, наприклад, конденсацією фенолів і амінофенолів з формальдегідом. Так, конденсуючи фенолсульфокислоту з формальдегідом, отримують полімер з активними по відношенню до йонного обміну сульфогрупами. Такий поліелектроліт нерозчинний у воді і у більшості розчинників, проте здатний до реакції йонного обміну.
Є дві групи іонітів: катіоніти, які мають властивості кислот і містять активні групи –SO3H, –CH2SO3H, –COOH та ін., і аніоніти, що мають властивості основ і містять активні групи –NH2, =NH, –NHR, –NR2 та ін.
Катіоніти дисоціюють з утворенням високомолекулярного аніона і рухливого Н+-іона, що може легко обмінюватися на інші катіони.
Аніоніти обмінюють ОН–-іони на інші аніони. Важливими вимогами до іонітів є їх активність, ємність, а також механічна, хімічна і термічна стійкість.
Схему йонного обміну, наприклад, з йонами Кальцію, можна представити так:
Ca2+ +  D
D 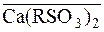 + 2H+.
+ 2H+.
Рискою зверху, над формулою, позначають фазу катіоніту чи аніоніту.
У наведеному прикладі використовується катіоніт у Н+-формі. Проте відомо, що йони Н+ сильно поглинаються різними сорбентами. Крім того, гідроген-іони утворюють малодисоційовані сполуки з аніонами слабких кислот, зокрема із залишками йонообмінних груп. Тому при роботі з катіонітом в Н+-формі гідроген-іони конкурують з йонами металів в йонообмінних групах, що ускладнює йонний обмін. Зручніше застосовувати катіоніт у натрієвій формі (Na+-форма). Для приготування такої форми катіоніт спочатку промивають розчином хлоридної кислоти, отримуючи при цьому Н+-форму. Після цього відмивають катіоніт від хлоридної кислоти дистильованою водою (проба на Cl–-іони), а потім довгий час промивають розчином натрій хлориду, його надлишок відмивають дистильованою водою. У більшості випадків реакції йонного обміну зворотні. Тому катіоніт після роботи легко регенерувати. Здебільшого поглинуті йони металів вимивають розчином хлоридної кислоти, отримуючи катіоніт в Н+-формі, а потім переводять в Na+-форму.
Розрізняють два способи застосування іонітів: статичний і динамічний. У статичному способі йонообмінник вносять безпосередньо у посудину, де відбувається реакція, і перемішують з розчином. У такий спосіб роблять тоді, коли необхідно регулювати pH у процесі йонного обміну. Зерна йонообмінника вносять поступово, контролюючи як вилучення йона, що визначається, так і pH розчину.
Але частіше застосовується динамічний спосіб. У цьому випадку зерна іоніту вносять у колонку, а потім, не перемішуючи шар зерен, пропускають досліджуваний розчин. Зерна, що знаходяться у нижній частині колонки, служать скоріш за все для контролю випадкового проскоку йонів, що поглинаються. При динамічному способі досягається більш високий ступінь вилучення йонів з розчину, оскільки, проходячи через шар іоніту, розчин зустрічає ще свіжі, які не прореагували, зерна іоніту.
Існує три основних типи йоннообмінної хроматографії:
§ фронтальний аналіз;
§ витискувальний аналіз;
§ елюційний аналіз.
Фронтальний аналіз полягає в тому, що якщо розчин, що містить декілька йонів з різними константами обміну, пропускати через колонку з іонітом у кількості, достатній для вичерпання її ємності, то першим із колонки виходить йон, що поглинається в найменшій мірі.
Якщо застосовується витискувальний аналіз, то в даному методі суміш йонів сорбується з розчину іонітом, через який потім пропускають розчин речовини, що краще поглинається іонітом, ніж кожен із компонентів досліджуваної суміші. Ця речовина, що легко сорбується, витісняє йони, які сорбуються слабко. Кожен компонент суміші у свою чергу витісняє той компонент, який сорбується слабкіше. Але всі компоненти суміші рухаються по колонці з однаковою швидкістю.
При елюційному аналізі суміш, яку треба розділити, сорбують у вигляді вузької смуги у верхній частині колонки, заповненої іонітом, а потім колонку починають промивати розчином іншого йона, що має більш низький коефіцієнт обміну, ніж у компонентів суміші. Цей йон заздалегідь сорбований на більшій частині колонки. При цьому відбувається десорбція йонів досліджуваної суміші, які розділяються, відповідно до їх коефіцієнтів розподілення і від характера ізотерми адсорбції кожного йона.
Для йоннообмінної хроматографії необхідна більш висока колонка, ніж для проведення простих йоннообмінних розділень. Деякі колонки мають висоту 5-6 метрів при діаметрі 1см. Йони, які треба розділити, сорбуються вузькою смугою у верхній частині колонки. Розділення їх відбувається головним чином при переміщенні цих йонів вздовж колонки при елююванні. Інколи застосовують секційні колонки. Вони складаються із серії послідовних (не менш трьох) колонок, у яких послідовно зменшуються діаметри. Між кожною парою колонок встановлюється невелика ємність, у якій відбувається турбулентне змішування розчину. Такі системи значно покращують розділення речовин.
Аніоніти застосовують не тільки для розділення аніонів. Деякі аніоніти поглинають, наприклад, йони Zn2+, утворюючи комплекси типу амоніакатів, оскільки хімічні властивості аніоніту схожі на властивості амоніаку, якби він був нерозчинний у воді.
Для розділення йонів деяких металів використовують їх здатність утворювати ацидокомплекси. Наприклад, для розділення йонів Al3+ та Fe3+ до розчину додають концентровану хлоридну кислоту до концентрації 2моль/дм3. При цьому утворюється ацидокомплекс H[FeCl4], а Алюміній залишається у формі катіона. Потім суміш пропускають через аніоніт у Cl–-формі. Відбувається обмін йонів Cl– на 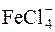 . Йони
. Йони 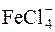 затримуються на колонці, а йони Al3+ проходять через колонку, не поглинаючись.
затримуються на колонці, а йони Al3+ проходять через колонку, не поглинаючись.
Іоніти характеризуються обмінною ємністю, величиною, яка показує максимальну кількість йонів, яку здатний зв’язати йонообмінник. Обмінна ємність визначається кількістю фіксованих йонів (RKt+, RA–), від яких залежить заряд матриці. Це означає, що електричний заряд йонів, у будь-якому місці і часі в іоніті має бути компенсований зарядом протиіонів, тобто йонами, які компенсують заряд каркаса йонообмінника (ОН–, Н+). Для низькомолекулярних йонів обмінна ємність йонообмінника залежить від ступеня доступності всього об’єму пористої матриці для молекул чи йонів, від співвідношення розмірів молекул речовини, а також від середньої відстані між йоногенними групами.
У йонному обміні беруть участь не тільки йони досліджуваної речовини, а також йони буферних розчинів, внаслідок чого рівновага pH може змінюватись. Тому, як правило, аніонні буфери використовуються з катіонітами, а катіонні буфери – з аніонітами. Оскільки зв’язування залежить від йонної сили, вибрані буферні розчини повинні мати більшу ємність, але при цьому йонна сила не повинна бути занадто великою. Йонні умови при елююванні мають бути тотожними йонним умовам досліджуваного розчину на початку дослідження.
Вибір того чи іншого йонообмінника для конкретного хроматографування визначається насамперед його загальною і реальною ємністю, а також пористістю та ситовим розміром часток. Для розділення низькомолекулярних сполук використовують іоніти з невеликими розмірами пор, тобто з високим ступенем зшивання, а для розділення макромолекул (білки, полінуклеотиди та ін.) – сорбенти з великими розмірами пор. Проте, більшість йонообмінників, за винятком сефадексів, не виявляють помітну залежність між пористістю і молекулярною масою речовин, що розділяються. Ефективність розділення речовин і швидкість хроматографічного процесу залежить від розмірів крупинок сорбенту. Діапазон лінійних розмірів іоніту зазначається в мікронах або у вигляді інтервалу чисел „МЕШ” (ситовий розмір). Ситовий розмір – це розмір частинок іоніту, який задається при просіюванні їх на стандартних ситах. Наприклад, сито (20-50меш) має 20-50 отворів власної площі. У більшості випадків застосовують іоніти від 20-50меш (великі за розміром частинки), до 200-400меш (найдрібніші). Іоніти з дрібними частинками мають більш високе співвідношення площі поверхні і об’єму, а отже і більшу ємність, менший час обміну. Але з іншого боку, при цьому уповільнюється швидкість току, що може спричинитися до збільшення розмивання зон та погіршення розділення. Іоніти з дрібними частинками застосовуються для аналітичного розділення речовин, а з великими розмірами крупинок – для грубого аналізу або препаративного одержання речовин. На практиці оптимальний ситовий розмір підбирають емпірично.
Є багато іонітів, які застосовуються в йоннообмінній хроматографії. Вибір того, чи іншого іоніту визначається завданнями, що стоять перед дослідженням даної суміші речовин, характером цих речовин, їх будовою і властивостями, розмірами молекул чи йонів.
Як матриці іонітів застосовують природні та синтетичні полімери: целюлозу, декстрани, полімери на основі стиролу та дивінілбензену, поліакриламідні, поліфенольні полімери та ін.
Розрізняють сильнокислотні катіоннообмінні смоли, сильноосновні аніонообмінні смоли. Прикладом сильнокислотного катіоніту може бути полімер, отриманий конденсацією фенолу, фенолсульфокислоти та формальдегіду, а також катіоніти, отримані сульфуванням кополімерів стиролу та дивінілбензену. Останні практично нерозчинні у воді, але в деяких органічних розчинниках набухають. Ступінь набухання залежить від ступеня поперечної зшивки: чим вона менше, тим у більшій мірі і швидше відбувається набухання. Сульфування поперечнозв’язаних полімерів проводять за допомогою різних сульфуючих речовин: олеума, хлорсульфонової кислоти і ін. Такі смоли стабільні, термо- та хімічно стійкі.
Слабкокислотні катіоніти отримують на основі, наприклад, метакрилової кислоти, малеїнового ангідриду або полімеризацією метакрилової кислоти з дивінілбензеном.
Сильноосновні аніоніти отримують дією на поперечнозшитий полістирол монохлордиметиловим етером у присутності каталізатора Фріделя-Крафтса. Продукт хлорметилювання обробляють третинним аміном і отримують полімер, що містить сильноосновні групи четвертинної амонієвої основи.
Обмінну ємність іоніту можна розрахувати виходячи з кількості дисоційованих чи спроможних дисоціювати груп, що припадають на одиницю маси або об’єму іоніту.
Можна припустити, що сильнокислотні та сильноосновні іоніти за всіх умов повністю або майже повністю дисоційовані. Їх сольові форми стабільні і не гідролізуються при промиванні. Вони характеризуються високою швидкістю йонного обміну.
Слабкокислотні і слабкоосновні іоніти в сольових формах нестійкі і повільно гідролізуються при промиванні водою. У сольовій формі вони мають високі швидкості йонного обміну, але будучи переведені в кислотну чи основну форму, реагують дуже повільно.
Для регенерації слабкокислотних катіонітів необхідний незначний надлишок кислоти, тому що карбоксильні групи в кислому середовищі дисоційовані в незначній мірі. Навпаки, для регенерації сильнокислотного катіоніту треба великий надлишок кислоти. Аналогічно регенерацію слабкоосновних аніонітів проводять незначним надлишком лугу, а сильноосновні аніоніти потребують значного надлишку основи.
На характеристики йоннообмінних смол значно впливає ступінь поперечної зшивки, яка визначає вологомісткість смоли. Коли повністю набухлий катіоніт у сольовій формі входить в контакт з водним розчином солі чи гідроксиду того ж металу, відбувається втрата води смолою і проникнення всередину зерен деякої кількості електроліту. Як ступінь зменшення набухання, так і ступінь проникнення електроліту в полімер знижується із збільшенням поперечної зв’язаності. Те ж саме спостерігається, коли набухла смола контактує з розчином неелектроліту.
В залежності від умов швидкість йонного обміну може визначатися або дифузією в зерні смоли, або дифузією у плівці між зерном і зовнішньою рідиною.
Так, для обміну гідроген-іонів на йони Na+ у сульфованих полістирольних іонітах, зшитих дивінілбензеном, було встановлено, що при низьких концентраціях Na+-іонів (<0,05моль/дм3) швидкість обміну визначається дифузією у плівці, а при високих концентраціях (>1моль/дм3) визначальною є дифузія в зерні полімеру. Знаючи діаметр набухлого зерна та швидкість йонного обміну при високих концентраціях, можна розрахувати ефективні коефіцієнти дифузії Na+-іонів і гідроген-іонів у зерні. Було встановлено, наприклад, що швидкість йонного обміну в іоніті з 5% зшивки дивінілбензеном більш, ніж у 6 разів перевищує швидкість в іоніті з 17% зшивки.
Для пояснення закономірностей йоннообмінних процесів існує декілька теорій. Згідно з однією з них, йонообмінний полімер можна розглядати як набухлий гель, в якому встановилась рівновага між тиском набухання (або осмотичним тиском) та пружними силами зшитої матриці полімера. Будь-яка зміна умов порушує цей баланс і система переходить в новий стан рівноваги. Так, наприклад, якщо повністю набухлий іоніт в Na+-формі перевести в Н+-форму, зерна іоніту дещо збільшаться у розмірах; це збільшення тим менше, чим більший ступінь поперечної зшивки полімеру. Згідно цієї теорії, заміна йона з малим радіусом на йон з великим радіусом призводить до того, що вуглеводневий скелет полімера розширюється; при цьому пружні сили зростають, викликаючи у свою чергу збільшення внутрішнього тиску на рухливі елементи набухлого полімера, внаслідок чого деяка частина «вільної» води витискується з матриці полімера. «Вільною» водою називається та частина внутрішньої води, яка не входить у гідратні оболонки йонів. У результаті встановлюється нова рівновага, при якій збільшення об’єму іоніту буде меншим, ніж різниця об’ємів гідратованих Н+-іонів та Na+-іонів. Із зменшенням ступеня зшивки полімера зменшуються і сили пружності, що виникають при даному збільшенні об’єму, у зв’язку з чим кількість «вільної» води, що витискується з матриці іоніту при заданій зміні йонного складу, буде меншою, а кінцеве збільшення об’єму полімера, отже, буде більшим.
Аналізуючи значення коефіцієнтів активностей йонів та селективності при йонному обміні можна зробити наступні висновки:
1. При малих концентраціях у водних розчинах та звичайній температурі ступінь обміну збільшується із збільшенням заряду йона, який обмінюється:
Na+ < Са2+ < Аl3+;
2. При малих концентраціях у водних розчинах, звичайній температурі і одному й тому ж ступені окиснення, ступінь обміну збільшується із збільшенням атомного номера йона, який обмінюється:
Li+ < Na+ < K+ < Rb+ < Cs+; Mg2+ < Ca2+ < Sr2+ < Ba2+;
3. При високих концентраціях зменшуються відмінності в потенціалі обміну йонів різного ступеня окиснення (наприклад, Na+ на Ca2+) і у деяких випадках йон з нижчим ступенем окиснення має більш високий обмінний потенціал;
4. Відносні обмінні потенціали різних йонів можна приблизно оцінити за їх коефіцієнтами активностей: чим вищий коефіцієнт активності, тим більший обмінний потенціал;
5. Обмінні потенціали Н3О+-іона та ОН– -іона помітно змінюються в залежності від аніона чи катіона відповідно; величина потенціалів залежить від сили кислоти чи основи відповідно. Чим сильніша кислота чи основа, тим нижчий обмінний потенціал;
6. Органічні йони високої молекулярної маси і складні комплексні йони мають надзвичайно високі обмінні потенціали;
7. При зниженні ступеня зшивки або зменшенні концентрації йонів, зафіксованих в іоніті, константа обмінної рівноваги прагне до одиниці.
Швидкість йонообмінних реакцій з іонітом визначається швидкістю підведення та відведення йонів до місць, де розташовані фіксовані йони полімера, і від них. Сама хімічна взаємодія йонів протікає досить швидко. Кінетика обміну скоріш за все описується законами дифузії, ніж законами гомогенних реакцій.
Серед катіонітів набули поширення такі як СП-сефадекс на основі декстрану з функціональними сульфогрупами, КМ-сефадекс на основі декстрану з карбоксиметильними функціональними групами, КМ-целюлоза з карбоксильними функціональними групами, фосфоцелюлоза, дауекс-50W – сильнокислотний катіоніт, кополімер стиролу і дивінілбензену із сульфогрупами в ядрі та ін.
Серед аніонітів застосовуються КАЕ-сефадекс на основі декстрану, що містить диетил-(2-оксипропіл)-аміноетильні функціональні групи, ДЕАЕ-сефадекс на основі декстрану з диетиламіноетильними функціональними групами, ДЕАЕ-целюлоза, що містить теж диетиламіноетильні групи, ПЕІ-целюлоза з поліетиленімінними функціональними групами, дауекс 21К – сильноосновний аніоніт з триметилбензиламонієвими функціональними групами та ін.
Незважаючи на велику різноманітність марок іонітів, всі вони по суті є або аніонітами, слабкоосновними чи сильноосновними, або катіонітами, слабкокислотними чи сильнокислотними. Аніоніт можна розглядати як нерозчинну основу, а катіоніт – як нерозчинну кислоту. В аналітичній хімії використовують також різні суміші цих двох класів іонітів. Їх застосовують, наприклад, для видалення з води майже всіх катіонів і аніонів одноразовим пропусканням води через йоннообмінну колонку. Така вода набагато чистіша, ніж дистильована, вона має рН близько 6,9, тоді як рН звичайної дистильованої води дорівнює 4,5 у зв’язку з розчиненим у ній вуглекислим газом.
Дата добавления: 2015-12-26; просмотров: 1373;
