Типи найбільш поширених комплексів
Виключний інтерес для аналітичної хімії представляють комплекси, у яких лігандами є молекули амоніаку. Схильність солей до утворення комплексів з амоніаком настільки велика, що рівновага повністю зміщується в бік утворення комплексу. Так, наприклад, у розчині, що містить [Cu(NH3)4]2+, міститься лише один йон Cu2+ на 1·1011 комплексних йонів. Малорозчинні аргентум галогеніди також розчиняються у розчині амоніаку з утворенням безбарвних розчинних комплексів, що містять йон [Ag(NH3)2]+.
Йон Ni2+ утворює з амоніаком два комплексних йона. При додаванні до розчину, що містить йони Ni2+, невеликої кількості розчину амоніаку в осад випадає нікол гідроксид Ni(OH)2 світло-зеленого кольору. При внесенні деякого надлишку розчину амоніаку осад розчиняється, розчин набуває темно-синього забарвлення, що містить йони [Ni(NH3)4]2+, а з великим надлишком амоніаку утворюється йон [Ni(NH3)6]2+ і розчин забарвлюється у блакитний колір.
Кобальт з амоніаком утворює ряд комплексних сполук. Якщо до розчину, що містить кобальт (ІІ) хлорид і амоній хлорид, додати розчин амоніаку, то Со2+ зразу ж окиснюється до Со3+ киснем повітря і утворюється комплекс [Со(NH3)6]Сl3 жовтого кольору. З маточного розчину виділяється інший комплекс – [Со(NH3)5Н2О]Сl3 рожевого кольору. У цьому комплексі одна молекула води заміщує одну молекулу амоніаку; координаційне число кобальту залишається рівним 6. У обох цих комплексах хлорид-іони знаходяться в зовнішній координаційній сфері і можуть бути осаджені йонами Аg+. При нагріванні до 100°С комплекс [Со(NH3)5Н2О]Cl3 втрачає молекулу води; при цьому утворюється комплекс [Со(NH3)5Cl]Cl2 червоно-пурпурового забарвлення. У цьому комплексі тільки два йона Cl– осаджуються йонами Аg+, а третій йон Cl– міцно зв’язаний у внутрішній координаційній сфері. Існує також комплекс [Со(NH3)4Cl2]Cl, у якому за допомогою Аg+ виявляється тільки один йон Cl–.
Солі Хрому утворюють з амоніаком теж декілька комплексних йонів, які сильно відрізняються забарвленням:
§ [Сr(NH3)6]3+ – жовтий;
§ [Сr(NH3)5Cl]2+ – пурпурово-червоний;
§ [Сr(NH3)4Cl2]+ – зелений;
§ [Сr(NH3)2Cl4]– – темно-зелений.
На відміну від йонів Со2+, Ni2+, Cu2+, Cr2+, Ag+, Hg2+, які легко утворюють комплекси з амоніаком, йони Аl3+, Fe2+, Fe3+ амоніачних комплексів не утворюють.
Однозарядні йони металів у більшості випадків зв’язують дві, двозарядні – чотири, тризарядні – шість молекул амоніаку. Елемент, що має змінні ступені окиснення, утворює комплекси, у яких координаційне число комплексоутворювача збільшується із збільшенням ступеня окиснення.
Для аналітичної хімії являють інтерес цілий ряд галогенокомплексів з галогеном у внутрішній координаційній сфері з різними катіонами у зовнішній координаційній сфері:
[BF4]–; [SnCl6]2–; [PtCl6]2– та ін.
Надзвичайно стійкими є комплексні ціаніди: [Ag(CN)2]–; [Cu(CN)2]–; [Cu(CN)4]3–; [Au(CN)2]–; [Fe(CN)6]3–; [Fe (CN)6]4– та ін.
Стійкість комплексів характеризується константою рівноваги дисоціації комплексного йона. Наприклад:
[Ag(CN)2]– D Ag++2CN–

Така константа рівноваги K називається константою нестійкості комплексного йона. Величина, обернена константі нестійкості, називається константою стійкості комплексу.
До складу комплексних йонів можуть входити і аніони кисневмісних кислот. Наприклад:
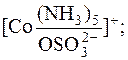
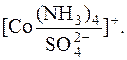
У першому випадку 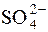 займає одне координаційне місце у Со3+, а у другому – два місця. У обох випадках координаційне число йона-комплексоутворювача дорівнює 6.
займає одне координаційне місце у Со3+, а у другому – два місця. У обох випадках координаційне число йона-комплексоутворювача дорівнює 6.
Дата добавления: 2015-12-26; просмотров: 713;
