Роль РНК в реализации наследственной информации
Наследственная информация, записанная с помощью генетического кода, хранится в молекулах ДНК и размножается для того, чтобы обеспечить вновь образуемые клетки необходимыми «инструкциями» для их нормального развития и функционирования. Вместе с тем непосредственного участия в жизнеобеспечении клеток ДНК не принимает. Роль посредника, функцией которого является перевод наследственной информации, сохраняемой в ДНК, в рабочую форму, играют рибонуклеиновые кислоты — РНК.
В отличие от молекул ДНК рибонуклеиновые кислоты представлены одной полинуклеотидной цепью, которая состоит из четырех разновидностей нуклеотидов, содержащих сахар, рибозу, фосфат и одно из четырех азотистых оснований — аденин, гуанин, урацил или цитозин. РНК синтезируется на молекулах ДНК при помощи ферментов РНК-полимераз с соблюдением принципа комплементарности и антипараллельности, причем аденину ДНК в РНК комплементарен урацил. Все многообразие РНК, действующих в клетке, можно разделить на три основных вида: мРНК, тРНК, рРНК.
Матричная, или информационная, РНК (мРНК, или иРНК). Транскрипция. Для того чтобы синтезировать белки с заданными свойствами, к месту их построения поступает «инструкция» о порядке включения аминокислот в пептидную цепь. Эта инструкция заключена в нуклеотидной последовательности матричных, или информационных РНК (мРНК, иРНК), синтезируемых на соответствующих участках ДНК. Процесс синтеза мРНК называют транскрипцией.
Синтез мРНК начинается с обнаружения РНК-полимеразой особого участка в молекуле ДНК, который указывает место начала транскрипции — промотора. После присоединения к промотору РНК-полимераза раскручивает прилежащий виток спирали ДНК. Две цепи ДНК в этом месте расходятся, и на одной из них фермент осуществляет синтез мРНК. Сборка рибонуклеотидов в цепь происходит с соблюдением их комплементарности нуклеотидам ДНК, а также антипараллельно по отношению к матричной цепи ДНК. В связи с тем, что РНК-полимераза способна собирать полинуклеотид лишь от 5'-конца к 3'-концу, матрицей для транскрипции может служить только одна из двух цепей ДНК, а именно та, которая обращена к ферменту своим 3'-концом (3' → 5'). Такуюцепь называют кодогенной (рис. 3.24). Антипараллельность соединения двух полинуклеотидных цепей в молекуле ДНК позволяет РНК-полимеразе правильно выбрать матрицу для синтеза мРНК.
Продвигаясь вдоль кодогенной цепи ДНК, РНК-полимераза осуществляет постепенное точное переписывание информации до тех пор, пока она не встречает специфическую нуклеотидную последовательность — терминатор транскрипции. В этом участке РНК-полимеразаотделяется как от матрицы ДНК, так и от вновьсинтезированной мРНК (рис. 3.25). Фрагмент молекулы ДНК, включающий промотор,транскрибируемую последовательность и терминатор, образует единицу транскрипции — транскриптон.
В процессе синтеза, по мере продвижения РНК-полимеразы вдоль молекулы ДНК, пройденные ею одноцепочечные участки ДНК вновь объединяются в двойную спираль. Образуемая в ходе транскрипции мРНК содержит точную копию информации, записанной в соответствующем участке ДНК. Тройки рядом стоящих нуклеотидов мРНК, шифрующие аминокислоты, называют кодонами. Последовательность кодонов мРНК шифрует последовательность аминокислот в пептидной цепи. Кодонам мРНК соответствуют определенные аминокислоты (табл. 3.1).
Таблица 3.1. Генетический код мРНК (подчеркнуты кодоны-терминаторы)
Второйнуклеотид
| У | Ц | А | Г | ||||||||
| П Е Р В Ы Й Н У К Л Е О Т И Д | У | УУУ УУЦ УУФ УУГ | Фен Лей | УЦУ УЦЦ УЦА УЦГ | Сер | УАУ УАЦ УАА УАГ | Тир | УГУ УГЦ УГА УГГ | Цис Три | У Ц А Г | Т Р Е Т И Й Н У К Л Е О Т И Д |
| Ц | ЦУУ ЦУЦ ЦУА ЦУГ | Лей | ЦЦУ ЦЦЦ ЦЦА ЦЦГ | Про | ЦАУ ЦАЦ ЦАА ЦАГ | Гис Глн | ЦГУ ЦГЦ ЦГА ЦГГ | Арг | У Ц А Г | ||
| А | АУУ АУЦ АУА АУГ | Иле Мет | АЦУ АЦЦ АЦА АЦГ | Тре | ААУ ААЦ ААА ААГ | Асн Лиз | АГУ АГЦ АГА АГГ | Сер Арг | У Ц А Г | ||
| Г | ГУУ ГУЦ ГУА ГУГ | Вал | ГЦУ ГЦЦ ГЦА ГЦГ | Ала | ГАУ ГАЦ ГАА ГАГ | Лея Глу | ГГУ ГГЦ ГГА ГГГ | Гли | У Ц А Г |
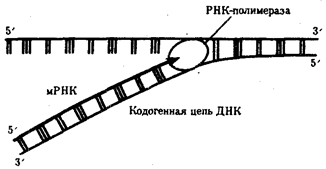
Рис. 3.24. Схема синтеза мРНК
Матрицей для транскрипции мРНК служит кодогенная цепьДНК, обращенная к ферменту своим 3'-концом
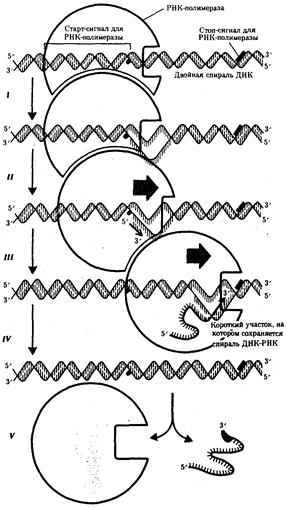
Рис. 3.25. Роль РНК-полимеразы в транскрипции:
I — обнаружение промоторной области в молекуле ДНК и раскручивание спирали ДНК; II — инициация синтеза цепи РНК путем связывания двух первых рибонуклеозидгрифосфатов; III — наращивание цепи РНК в направлении 5' → 3' путем присоединения рибонуклеозидгрифосфатов; IV — высвобождение 5'-конца синтезируемой РНК и восстановление двойной спирали ДНК; V — окончание синтеза РНК в области терминатора, отделение полимеразы от завершенной цепи РНК
Транспортная РНК (тРНК). Трансляция. Важная роль в процессе использования наследственной информации клеткой принадлежит транспортной РНК (тРНК). Доставляя необходимые аминокислоты к месту сборки пептидных цепей, тРНК выполняет функцию трансляционного посредника.
Молекулы тРНК представляют собой полинуклеотидные цепи, синтезируемые на определенных последовательностях ДНК. Они состоят из относительно небольшого числа нуклеотидов —75—95. В результате комплементарного соединения оснований, которые находятся в разных участках полинуклеотидной цепи тРНК, она приобретает структуру, напоминающую по форме лист клевера (рис. 3.26).
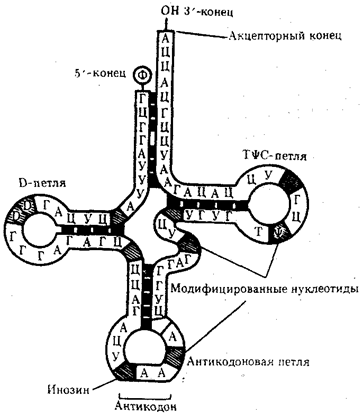
Рис. 3.26. Строение типичной молекулы тРНК
В ней выделяют четыре главные части, выполняющие различные функции. Акцепторный «стебель» образуется двумя комплементарно соединенными концевыми частями тРНК. Он состоит из семи пар оснований. 3'-конец этого стебля несколько длиннее и формирует одноцепочечный участок, который заканчивается последовательностью ЦЦА со свободной ОН-группой. К этому концу присоединяется транспортируемая аминокислота. Остальные три ветви представляют собой комплементарно спаренные последовательности нуклеотидов, которые заканчиваются неспаренными участками, образующими петли. Средняя из этих ветвей — антикодоновая — состоит из пяти пар нуклеотидов и содержит в центре своей петли антикодон. Антикодон — это три нуклеотида, комплементарные кодону мРНК, который шифрует аминокислоту, транспортируемую данной тРНК к месту синтеза пептида.
Между акцепторной и антикодоновой ветвями располагаются две боковые ветви. В своих петлях они содержат модифицированные основания —дигидроуридин (D-петля) и триплет TψC, где \у — псевдоуриаин (Т^С-петля). Между аитикодоновой и Т^С-ветвями содержится дополнительная петля, включающая от 3—5 до 13—21 нуклеотидов.
В целом различные виды тРНК характеризуются определенньм постоянством нуклеотидной последовательности, которая чаще всего состоит из 76 нуклеотидов. Варьирование их числа связано главным образом с изменением количества нуклеотидов в дополнительной петле. Комплементарные участки, поддерживающие структуру тРНК, как правило, консервативны. Первичная структура тРНК, определяемая последовательностью нуклеотидов, формирует вторичную структуру тРНК, имеющую форму листа клевера. В свою очередь, вторичная структура обусловливает трехмерную третичную структуру, для которой характерно образование двух перпендикулярно расположенных двойных спиралей (рис. 3.27). Одна из них образована акцепторной и ТψС-ветвями, другая —антикодоновой и D-ветвями.
На конце одной из двойных спиралей располагается транспортируемая аминокислота, на конце другой — антикодон. Эти участки оказываются максимально удаленными друг от друга. Стабильность третичной структуры тРНК поддерживается благодаря возникновению дополнительных водородных связей между основаниями полинуклеотидной цепи, находящимися в разных ее участках, но пространственно сближенных в третичной структуре.
Различные виды тРНК имеют сходную третичную структуру, хотя и с некоторыми вариациями.
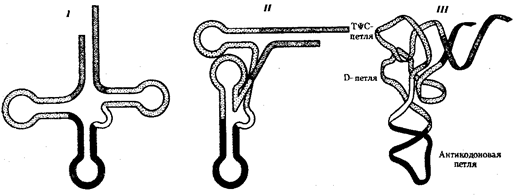
Рис. 3.27. Пространственная организация тРНК:
I —вторичная структура тРНК в виде «клеверного листа», определяемая ее первичной структурой (последовательностью нуклеотидов в цепи);
II — двумерная проекция третичной структуры тРНК;
III — схема укладкимолекулы тРНК в пространстве
Одной из особенностей тРНК является наличие в ней необычных оснований, возникающих вследствие химической модификации уже после включения нормального основания в полинуклеотидную цепь. Эти измененные основания обусловливают большое структурное многообразие тРНК при общем плане их строения. Наибольший интерес представляют модификации оснований, формирующих антикодон, которые влияют на специфичность его взаимодействия с кодоном. Например, нетипичное основание инозин, иногда стоящий в 1-м положении антикодона тРНК, способен комплементарно соединяться с тремя разными третьими основаниями кодона мРНК — У, Ц и А (рис. 3.28). Так как одной из особенностей генетического кода является его вырожденность (см. разд. 3.4.1.2), многие аминокислоты шифруются несколькими кодонами, которые, как правило, различаются своим третьим основанием. Благодаря неспецифичности связывания модифицированного основания антикодона одна тРНК узнает несколько кодонов-синонимов.
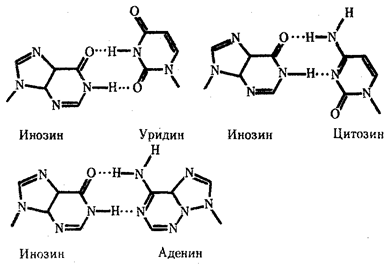
Рис. 3.28. Соединение инозина водородными связями с тремя различными азотистыми основаниями Водородные связи обозначены точками
Установлено также существование нескольких видов тРНК, способных соединяться с одним и тем же кодоном. В результате в цитоплазме клеток встречается не 61 (по количеству кодонов), а около 40 различных молекул тРНК. Этого количества достаточно, чтобы транспортировать 20 разных аминокислот к месту сборки белка.
Наряду с функцией точного узнавания определенного кодона в мРНК молекула тРНК осуществляет доставку к месту синтеза пептидной цепи строго определенной аминокислоты, зашифрованной с помощью данного кодона. Специфическое соединение тРНК со «своей» аминокислотой протекает в два этапа и приводит к образованию соединения, называемого аминоацил-тРНК (рис. 3.29).
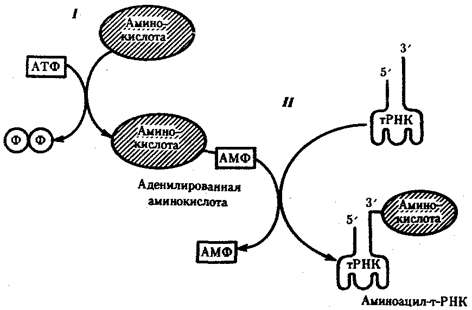
Рис. 3.29. Присоединение аминокислоты к соответствующей тРНК:
I — 1-й этап, взаимодействие аминокислоты и АТФ с выделением пирофосфата;
II — 2-й этап, присоединение аденилировашюй аминокислоты к 3'-концу РНК
На первом этапе аминокислота активируется, взаимодействуя своей карбоксильной группой с АТФ. В результате образуется адепилированная аминокислота.
На втором этапе это соединение взаимодействует с ОН-группой, находящейся на 3'-конце соответствующей тРНК, и аминокислота присоединяется к нему своей карбоксильной группой, высвобождая при этом АМФ. Таким образом, этот процесс протекает с затратой энергии, получаемой при гидролизе АТФ до АМФ.
Специфичность соединения аминокислоты и тРНК, несущей соответствующий антикодон, достигается благодаря свойствам фермента аминоацил-тРНК-синтетазы. В цитоплазме существует целый набор таких ферментов, которые способны к пространственному узнаванию, с одной стороны, своей аминокислоты, а с другой — соответствующего ей антикодона тРНК (рис. 3.30).
Наследственная информация, «записанная» в молекулах ДНК и «переписанная» на мРНК, расшифровывается в ходе трансляции благодаря двум процессам специфического узнавания молекулярных поверхностей. Сначала фермент аминоацил-тРНК-синтетаза обеспечивает соединение тРНК с транспортируемой ею аминокислотой. Затем аминоацил-тРНК комплементарно спаривается с мРНК благодаря взаимодействию антикодона с кодоном. С помощью системы тРНК язык нуклеотидной цепи мРНК. транслируется в язык аминокислотной последовательности пептида (рис. 3.30).
Рибосомная РНК (рРНК). Рибосомный цикл синтеза белка. Процесс взаимодействия мРНК и тРНК, обеспечивающий трансляцию информации с языка нуклеотидов на язык аминокислот, осуществляется на рибосомах. Последние представляют собой сложные комплексы рРНК и разнообразных белков, в которых первые образуют каркас. Рибосомные РНК являются не только структурным компонентом рибосом, но и обеспечивают связывание их с определенной нуклеотидной последовательностью мРНК. Этим устанавливаются начало и рамка считывания при образовании пептидной цепи. Кроме того, они обеспечивают взаимодействие рибосомы и тРНК. Многочисленные белки, входящие в состав рибосом наряду с рРНК, выполняют как структурную, так и ферментативную роль.
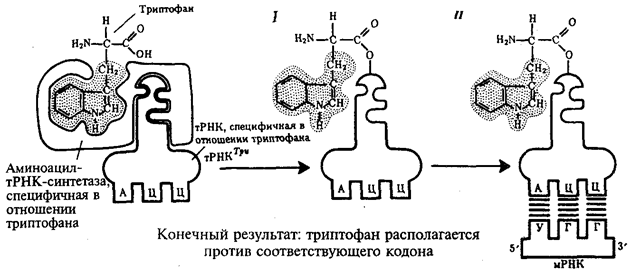
Рис. 3.30. Схема трансляции генетического кода:
I — присоединение аминокислоты (триптофана) к соответствующей тРНК с помощью фермента аминоацил-тРНК-синтетазы; II — присоединение тРНК, несущей свою аминокислоту, к мРНК благодаря связыванию ее антикодона с кодоном мРНК
Рибосомы про- и эукариот очень сходны по структуре и функциям. Они состоят из двух субчастиц: большой и малой. У эукариот малая субчастица образована одной молекулой рРНК и 33 молекулами разных белков. Большая субчастица объединяет три молекулы рРНК и около 40 белков. Прокариотические рибосомы и рибосомы митохондрий и пластид содержат меньше компонентов.
В рибосомах имеется две бороздки. Одна из них удерживает растущую полипептидную цепь, другая — мРНК. Кроме того, в рибосомах выделяют два участка, связывающих тРНК. В аминоацильном, А-участке размещается аминоацил-тРНК, несущая определенную аминокислоту. В пептидильном, П-участке располагается обычно тРНК, которая нагружена цепочкой аминокислот, соединенных пептидными связями. Образование А- и П-участков обеспечивается обеими субчастицами рибосомы.
В каждый момент рибосома экранирует сегмент мРНК протяженностью около 30 нуклеотидов. При этом обеспечивается взаимодействие только двух тРНК с двумя расположенными рядом кодонами мРНК (рис. 3.31).
Трансляция информации на «язык» аминокислот выражается в постепенном наращивании пептидной цепи в соответствии с инструкцией, заключенной в мРНК. Этот процесс протекает на рибосомах, которые обеспечивают последовательность расшифровки информации с помощью тРНК. В ходе трансляции можно выделить три фазы: инициацию, элонгацию и терминацию синтеза пептидной цепи.
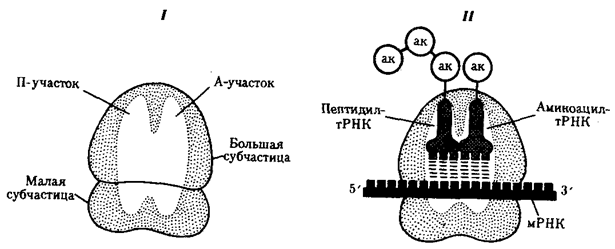
Рис. 3.31. Участки связывания молекул тРНК и рибосомы:
I — ненагруженная рибосома, II — нагруженная рибосома; ак — аминокислота
Фаза инициации, или начало синтеза пептида, заключается в объединении двух находящихся до этого порознь в цитоплазме субчастиц рибосомы на определенном участке мРНК и присоединении к ней первой аминоацил-тРНК. Этим задается также рамка считывания информации, заключенной в мРНК (рис. 3.32).
В молекуле любой мРНК вблизи ее 5'-конца имеется участок, комплементарный рРНК малой субчастицы рибосомы и специфически узнаваемый ею. Рядом с ним располагается инициирующий стартовый кодон АУТ, шифрующий аминокислоту метионин. Малая субчастица рибосомы соединяется с мРНК таким образом, что стартовый кодон АУТ располагается в области, соответствующей П-участку. При этом только инициирующая тРНК, несущая метионин, способна занять место в недостроенном П-участке малой субчастицы и комплементарно соединиться со стартовым кодоном. После описанного события происходит объединение большой и малой субчастиц рибосомы с образованием ее пептидильного и аминоацильного участков (рис. 3.32).
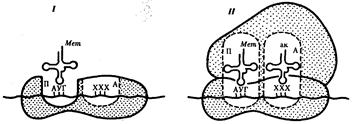
Рис. 3.32. Инициация белкового синтеза:
I — соединение малой субчаспщы рибосомы с мРНК, присоединение к стартовому кодону несущей метионин тРНК, которая располагается в недостроенном П-участке; II — соединение большой и малой субчастиц рибосомы с образованием П- и А-участков; следующий этап связан с размещением в А-участке аминоацил-тРНК, соответствующей расположенномув нем кодону мРНК,—начало элонгации; ак — аминокислота
К концу фазы инициации П-участок занят аминоацил-тРНК, связанной с метионином, тогда как в А-участке рибосомы располагается следующий за стартовым кодон.
Описанные процессы инициации трансляции катализируются особыми белками — факторами инициации, которые подвижно связаны с малой субчастицей рибосомы. По завершении фазы инициации и образования комплекса рибосома — мРНК — инициирующая аминоацил-тРНК эти факторы отделяются от рибосомы.
Фаза элонгации, или удлинения пептида, включает в себя все реакции от момента образования первой пептидной связи до присоединения последней аминокислоты. Она представляет собой циклически повторяющиеся события, при которых происходит специфическое узнавание аминоацил-тРНК очередного кодона, находящегося в А-участке, комплементарное взаимодействие между антикодоном и кодоном.
Благодаря особенностям трехмерной организации тРНК. (см. разд. 3.4.3.1) при соединении ее антикодона с кодоном мРНК. транспортируемая ею аминокислота располагается в А-участке, поблизости от ранее включенной аминокислоты, находящейся в П-участке. Между двумя аминокислотами образуется пептидная связь, катализуемая особыми белками, входящими в состав рибосомы. В результате предыдущая аминокислота теряет связь со своей тРНК и присоединяется к аминоацил-тРНК, расположенной в А-участке. Находящаяся в этот момент в П-участке тРНК высвобождается и уходит в цитоплазму (рис. 3.33).
Перемещение тРНК, нагруженной пептидной цепочкой, из А-участка в П-участок сопровождается продвижением рибосомы по мРНК на шаг, соответствующий одному кодону. Теперь следующий кодон приходит в контакт с А-участком, где он будет специфически «опознан» соответствующей аминоацил-тРНК, которая разместит здесь свою аминокислоту. Такая последовательность событий повторяется до тех пор, пока в А-участок рибосомы не поступит кодон-терминатор, для которого не существует соответствующей тРНК.
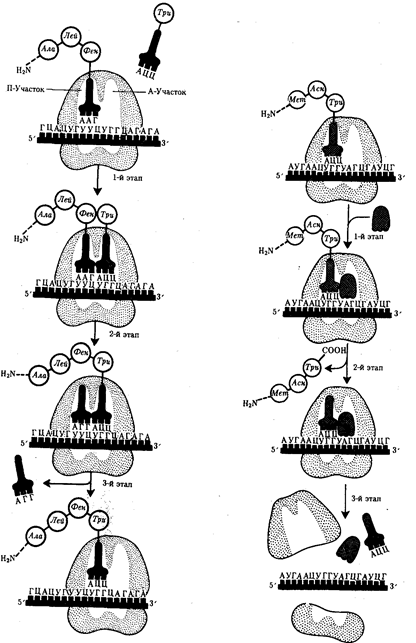
| Рис. 3.33. Фаза элонгации в синтезе белка: 1-й этап—аминоацил-тРНК присоединяется к кодону, расположенному в А-участке; 2-й этап — между аминокислотами, расположенными в А- и П-участках, образуется пептидиая связь: тРНК, расположенная в П-участке, освобождается от своей аминокислоты и покидает рибосому; 3-й этап —рибосома перемещается по мРНК на один кодон так, что тРНК, нагруженная пептидной цепочкой, переходит из А-участка в П-участок; свободный А-участок может быть занят соответствующей аминоацил-тРНК | Рис. 3.34. Терминация синтеза пептидной цепи: 1-й этап — присоединение фактора освобождения к стоп-кодону; 2-й этап — терминация, высвобождение завершенного пептида; 3-й этап —диссоциация рибосомы на две субчастицы |
Сборка пептидной цепи осуществляется с достаточно большой скоростью, зависящей от температуры. У бактерий при 37 °С она выражается в добавлении к подипептиду от 12 до 17 аминокислот в 1 с. В эукариотических клетках эта скорость ниже и выражается в добавлении двух аминокислот в 1 с.
Фаза терминации, или завершения синтеза полипептида, связана с узнаванием специфическим рибосомным белком одного из терминирующих кодонов (УАА, УАГ или У ГА), когда тот входит в зону А-участка рибосомы. При этом к последней аминокислоте в пептидной цепи присоединяется вода, и ее карбоксильный конец отделяется от тРНК. В результате завершенная пептидная цепь теряет связь с рибосомой, которая распадается на две субчастицы (рис. 3.34).
Дата добавления: 2015-11-28; просмотров: 959;
