Тангенциальная составляющая ускорения 9 страница
Зная радиусы цилиндров, их угловую скорость вращения, а также измеряя s, можно вычислить скорость движения атомов серебра при данной температуре проволоки. Результаты опыта показали, что средняя скорость атомов серебра близка к той, которая следует из максвелловского распределения молекул по скоростям.
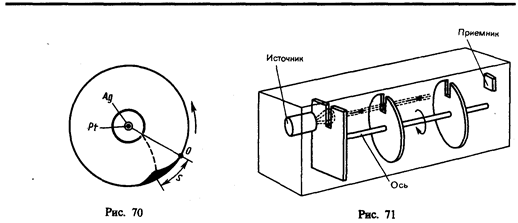
3. Опыт Ламмерт. Этот опыт позволяет более точно определить закон распределения молекул по скоростям. Схема вакуумной установки приведена на рис. 71. Молекулярный пучок, сформированный источником, проходя через щель, попадает в приемник. Между источником и приемником помещают два диска с прорезями, закрепленных на общей оси. При неподвижных дисках молекулы достигают приемника, проходя через прорези в обоих дисках. Если ось привести во вращение, то приемника достигнут только те прошедшие прорезь в первом диске молекулы, которые затрачивают для пробега между дисками время, равное или кратное времени оборота диска. Другие же молекулы задерживаются вторым диском. Меняя угловую скорость вращения дисков и измеряя число молекул, попадающих в приемник, можно выявить закон распределения молекул по скоростям. Этот опыт также подтвердил справедливость максвелловского распределения молекул по скоростям.
4. Опытное определение постоянной Авогадро. Воспользовавшись идеей распределения молекул по высоте (см. формулу (45.4)), французский ученый Ж. Перрен (1870—1942) экспериментально определил значение постоянной Авогадро. Исследуя под микроскопом броуновское движение, он убедился, что броуновские частицы распределяются по высоте подобно молекулам газа в поле тяготения. Применив к ним больцмановское распределение, можно записать
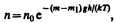
где т—масса частицы, т1—масса вытесненной ею жидкости; m=4/3pr3r, m1=4/3pr3r1 (r — радиус частицы, r — плотность частицы, r1 — плотность жидкости).
Если n1 и n2 — концентрации частиц на уровнях h1 и n2, a k=R/NA, то
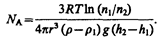
Значение NA, получаемое из работ Ж. Перрена, соответствовало значениям, полученным в других опытах, что подтверждает применимость к броуновским частицам распределения (45.4).
§ 48. Явления переноса в термодинамически неравновесных системах
В термодинамически неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос энергии, массы, импульса. К явлениям переноса относятся теплопроводность (обусловлена переносом энергии), диффузия (обусловлена переносом массы) и внутреннее трение (обусловлено переносом импульса). Для простоты ограничимся одномерными явлениями переноса. Систему отсчета выберем так, чтобы ось х была ориентирована в направлении переноса.
1. Теплопроводность. Если в одной области газа средняя кинетическая энергия молекул больше,чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивания средних кинетических энергий молекул, т. е., иными словами, выравнивание температур.
Перенос энергии в форме теплоты подчиняетсязакону Фурье:
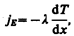 (48.1)
(48.1)
где jE —плотность теплового потока — величина, определяемая энергией, переносимой в форме теплоты в единицу времени через единичную площадку, перпендикулярную оси х, l — теплопроводность, 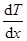 — градиент температуры, равный скорости изменения температуры на единицу длины х в направлении нормали к этой площадке. Знак минус показывает, что при теплопроводности энергия переносится в направлении убывания температуры (поэтому знаки jE и
— градиент температуры, равный скорости изменения температуры на единицу длины х в направлении нормали к этой площадке. Знак минус показывает, что при теплопроводности энергия переносится в направлении убывания температуры (поэтому знаки jE и 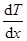 – противоположны). Теплопроводность l численно равна плотности теплового потока при градиенте температуры, равном единице.
– противоположны). Теплопроводность l численно равна плотности теплового потока при градиенте температуры, равном единице.
Можно показать, что
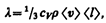 (48.2)
(48.2)
где сV — удельная теплоемкость газа при постоянном объеме (количество теплоты, необходимое для нагревания 1 кг газа на 1 К при постоянном объеме), r — плотность газа, <v> — средняя скорость теплового движения молекул, <l> — средняя длина свободного пробега.
2. Диффузия. Явление диффузии заключается в том, что происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия сводится к обмену масс частиц этих тел, возникает и продолжается, пока существует градиент плотности. Во время становления молекулярно-кинетической теории по вопросу диффузии возникли противоречия. Так как молекулы движутся с огромными скоростями, диффузия должна происходить очень быстро. Если же открыть в комнате сосуд с пахучим веществом, то запах распространяется довольно медленно. Однако противоречия здесь нет. Молекулы при атмосферном давлении обладают малой длиной свободного пробега и, сталкиваясь с другими молекулами, в основном «стоят» на месте.
Явление диффузии для химически однородного газа подчиняется закону Фука:
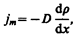 (48.3)
(48.3)
где jm —плотность потока массы — величина, определяемая массой вещества, диффундирующего в единицу времени через единичную площадку, перпендикулярную оси х, D —диффузия (коэффициент диффузии), dr/dx — градиент плотности, равный скорости изменения плотности на единицу длины х в направлении нормали к этой площадке. Знак минус показывает, что перенос массы происходит в направлении убывания плотности (поэтому знаки jm и dr/dx противоположны). Диффузия D численно равна плотности потока массы при градиенте плотности, равном единице. Согласно кинетической теории газов,
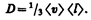 (48.4)
(48.4)
3. Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, движущегося медленнее — увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее.
Согласно формуле (31.1), сила внутреннего трения между двумя слоями газа (жидкости) подчиняется закону Ньютона:
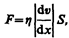 (48.5)
(48.5)
где h — динамическая вязкость (вязкость), dv/dx — градиент скорости, показывающий быстроту изменения скорости в направлении х, перпендикулярном направлению движения слоев, S — площадь, на которую действует сила F.
Взаимодействие двух слоев согласно второму закону Ньютона можно рассматривать как процесс, при котором от одного слоя к другому в единицу времени передается импульс, по модулю равный действующей силе. Тогда выражение (48.5) можно представить в виде
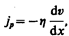 (48.6)
(48.6)
где jp —плотность потока импульса — величина, определяемая полным импульсом, переносимым в единицу времени в положительном направлении оси х через единичную площадку, перпендикулярную оси х, 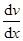 — градиент скорости. Знак минус указывает, что импульс переносится в направлении убывания скорости (поэтому знаки jр и
— градиент скорости. Знак минус указывает, что импульс переносится в направлении убывания скорости (поэтому знаки jр и 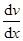 противоположны).
противоположны).
Динамическая вязкость h численно равна плотности потока импульса при градиенте скорости, равном единице; она вычисляется по формуле
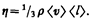 (48.7)
(48.7)
Из сопоставления формул (48.1), (48.3) и (48.6), описывающих явления переноса, следует, что закономерности всех явлений переноса сходны между собой. Эти законы были установлены задолго до того, как они были обоснованы и выведены из молекулярно-кинетической теории, позволившей установить, что внешнее сходство их математических выражений обусловлено общностью лежащего в основе явлений теплопроводности, диффузии и внутреннего трения молекулярного механизма перемешивания молекул в процессе их хаотического движения и столкновений друг с другом.
Рассмотренные законы Фурье, Фика и Ньютона не вскрывают молекулярно-кинетического смысла коэффициентов l, D и h. Выражения для коэффициентов переноса выводятся из кинетической теории. Они записаны без вывода, так как строгое рассмотрение явлений переноса довольно громоздко, а качественное — не имеет смысла. Формулы (48.2), (48.4) и (48.7) связывают коэффициенты переноса и характеристики теплового движения молекул. Из этих формул вытекают простые зависимости между l, D и h:
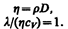
Используя эти формулы, можно по найденным из опыта одним величинам определить другие.
§ 48. Вакуум и методы его получения. Свойства ультраразреженных газов
Если из сосуда откачивать газ, то по мере понижения давления число столкновений молекул друг с другом уменьшается, что приводит к увеличению их длины свободного пробега. При достаточно большом разрежении столкновения между молекулами относительно редки, поэтому основную роль играют столкновения молекул со стенками сосуда.Вакуумом называется состояние газа, при котором средняя длина свободного пробега <l> сравнима или больше характерного линейного размера d сосуда, в котором газ находится. В зависимости от соотношения <l> и d различаютнизкий (<l> << d), средний (<l> £ d),высокий (<l> > d) исверхвысокий (<l> >> d) вакуум. Газ в состоянии высокого вакуума называетсяультраразреженным.
Вопросы создания вакуума имеют большое значение в технике, так как, например, во многих современных электронных приборах используются электронные пучки, формирование которых возможно лишь в условиях вакуума. Для получения различных степеней разрежения применяютсявакуумные насосы.В настоящее время применяются вакуумные насосы, позволяющие получить предварительное разрежение (форвакуум) до »0,13 Па, а также вакуумные насосы и лабораторные приспособления, позволяющие получить давление до 13,3 мкПа — 1,33 пПа (10–7 —10–14 мм рт. ст.).
Принцип работы форвакуумного насоса представлен на рис. 72. Внутри цилиндрической полости корпуса вращается эксцентрично насаженный цилиндр. Две лопасти 1 и 1', вставленные в разрез цилиндра и раздвигаемые пружиной 2, разделяют пространство между цилиндром и стенкой полости на две части. Газ из откачиваемого сосуда поступает в область 3, по мере поворачивания цилиндра лопасть 1 отходит, пространство 3 увеличивается и газ засасывается через трубку 4. При дальнейшем вращении лопасть 1' отключает пространство 3 от трубки 4 и начинает вытеснять газ через клапан 5 наружу. Весь процесс непрерывно повторяется.

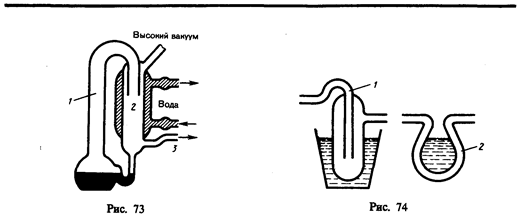
Для получения высокого вакуума применяютсядиффузионные насосы (рабочее вещество — ртуть или масло), которые не способны откачивать газ из сосудов начиная с атмосферного давления, но способны создавать добавочную разность давлений, поэтому их употребляют вместе с форвакуумными насосами. Рассмотрим схему действия диффузионного насоса (рис. 73). В колбе ртуть нагревается, пары ртути, поднимаясь по трубке 1, вырываются из сопла 2 с большой скоростью, увлекая за собой молекулы газа из откачиваемого сосуда (в нем создан предварительный вакуум). Эти пары, попадая затем в «водяную рубашку», конденсируются и стекают обратно в резервуар, а захваченный газ выходит в пространство (через трубку 3), в котором уже создан форвакуум. Если применять многоступенчатые насосы (несколько сопл расположены последовательно), то реально при хороших уплотнениях можно с помощью них получить разрежение до 10–7 мм рт. ст.
Для дальнейшего понижения давления применяются так называемые «ловушки». Между диффузионным насосом и откачиваемым объектом располагают специально изогнутое колено (1 или 2) соединительной трубки (ловушку), которую охлаждают жидким азотом (рис. 74). При такой температуре пары ртути (масла) вымораживаются и давление в откачиваемом сосуде понижается приблизительно на 1—2 порядка. Описанные ловушки называют охлаждаемыми; можно применять также неохлаждаемые ловушки. Специальное рабочее вещество (например, алюмогель) помещают в один из отростков соединительной трубка вблизи откачиваемого объекта, которое поддерживается при температуре 300°С. При достижении высокого вакуума алюмогель охлаждается до комнатной температуры, при которой он начинает поглощать имеющиеся в системе пары. Преимущество этих ловушек состоит в том, что с их помощью в откачиваемых объектах можно поддерживать высокий вакуум уже после непосредственной откачки в течение даже нескольких суток.
Остановимся на некоторых свойствах ультраразреженных газов. Так как в состоянии ультраразрежения молекулы практически друг с другом не сталкиваются, то газ в этом состоянии не обладает внутренним трением. Отсутствие соударений между молекулами разреженного газа отражается также на механизме теплопроводности. Если при обычных давлениях перенос энергии молекулами производится «эстафетой», то при ультраразрежении каждая молекула сама должна перенести энергию от одной стенки сосуда к другой. Явление уменьшения теплопроводности вакуума при понижении давления используется на практике для создания тепловой изоляции. Например, для уменьшения теплообмена между телом и окружающей средой тело помещают в сосуд Дьюара*, имеющий двойные стенки, между которыми находится разреженный воздух, теплопроводность которого очень мала.
* Д. Дьюар (1842—1923) — английскийхимик и физик.
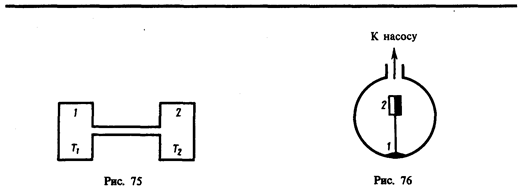
Рассмотрим два сосуда 1 и 2, поддерживаемых соответственно при температурах T1 и Т2 (рис. 75) и соединенных между собой трубкой. Если длина свободного пробега молекул гораздо меньше диаметра соединительной трубки (<l> << d), то стационарное состояние газа характеризуется равенством давлений в обоих сосудах (p1 = р2). Стационарное же состояние ультраразреженного газа (<l> >> d), находящегося в двух сосудах, соединенных трубкой, возможно лишь в том случае, когда встречные потоки частиц, перемещающихся из одного сосуда в другой, одинаковы, т. е.
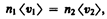
где п1и п2 — концентрации молекул в обоих сосудах, <v1> и <v2> — средние скорости молекул. Учитывая, что n = p/(kT) и 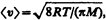 из условия (49.1) получаем
из условия (49.1) получаем
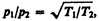 (49.2)
(49.2)
т. е. в условиях высокого вакуума выравнивания давлении не происходит. Если в откачанный стеклянный баллон (рве. 76) на пружину 1 насадить слюдяной листочек 2, одна сторона которого зачернена, и освещать его, то возникнет разность температур между светлой и зачерненной поверхностями листочка. Из выражения (49.2) следует, что в данном случае разным будет и давление, т. е. молекулы от зачерненной поверхности будут отталкиваться с большей силой, чем от светлой, в результате чего листочек отклонится. Это явление называется радиометрическим эффектом. На радиометрическом эффекте основано действие радиометрического манометра.
Задачи
8.1. Начертить и объяснить графики изотермического и изобарного процессов в координатах p и V, p и T, T и V.
8.2. В сосуде при температуре t = 20°C и давлении р = 0,2 МПа содержится смесь газов — кислорода массой m1 =16 г и азота массой m2 = 21 г. Определить плотность смеси. [2.5 кг/м3]
8.3. Определить наиболее вероятную скорость молекул газа, плотность которого при давлении 40 кПа составляет 0,38 кг/м3. [478 м/с]
8.4. Используя закон о распределении молекул идеального газа по скоростям, найти закон, выражающий распределение молекул по относительным скоростям и (u = v/vB). [ 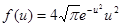 ]
]
8.5. Воспользовавшись законом распределения идеального газа по относительным скоростям (см. задачу 8.4), определить, какая доля молекул кислорода, находящегося при температуре t = 0°C, имеет скорости от 100 до 110 м/с. [0,4]
8.6. На какой высоте плотность воздуха в два раза меньше, чем его плотность на уровне моря? Считать, что температура воздуха везде одинакова и равна 273 К. [5,5 км]
8.7. Определить среднюю продолжительность свободного пробега молекул водорода при температуре 300 К и давлении 5 кПа. Эффективный диаметр молекул принять равным 0,28 нм. [170 нс]
8.8. Коэффициенты диффузии и внутреннего трения при некоторых условиях равны соответственно 1,42×10–4 м2/с и 8,5 мкПа×с. Определить концентрацию молекул воздуха при этих условиях. [1,25×1024 м–3]
Глава 9 Основы термодинамики
§ 50. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
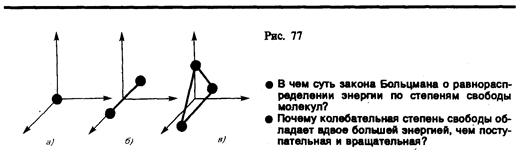
В § 1 было введено понятие числа степеней свободы: это число независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис. 77, а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (r ® 0, J = mr2® 0, Tвр=Jw2/2®0).
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 77, б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i = 5). Трехатомная (рис. 77, я) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения <e0> в (43.8):
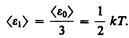
В классической статистической физике выводитсязакон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT.Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
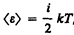
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:
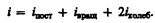
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равнасумме кинетических энергий Na молекул:
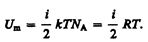 (50.1)
(50.1)
Внутренняя энергия для произвольной массы т газа.
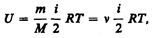
где М — молярная масса, n — количество вещества.
§ 51. Первое начало термодинамики
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы или сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего его температура повышается, т. е. тем самым изменяется (увеличивается) внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно увеличить за счет сообщения ему некоторого количества теплоты — энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами).
Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии DU=U2–U1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил:
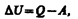
или
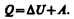 (51.1)
(51.1)
Уравнение (51.1) выражаетпервое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Выражение (51.1) в дифференциальной форме будет иметь вид
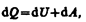
или в более корректной форме
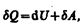 (51.2)
(51.2)
где dU — бесконечно малое изменение внутренней энергии системы, dA — элементарная работа, dQ — бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а dA и dQ таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме (51.2).
Из формулы (51.1) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии DU=0. Тогда, согласно первому началу термодинамики,
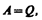
т. е. вечный двигатель первого рода — периодически действующий двигатель, который совершал бы бóльшую работу, чем сообщенная ему извне энергия, — невозможен (одна из формулировок первого начала термодинамики).
§ 52. Работа газа при изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
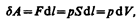
где S — площадь поршня, Sdl=dV— изменение объема системы. Таким образом,
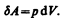 (52.1)
(52.1)
Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы (52.1):
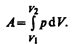 (52.2)
(52.2)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении изображается кривой на рис. 79. При увеличении объема на dV совершаемая газом работа равна pdV, т. е. определяется площадью полоски с основанием dV, заштрихованной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1 до объема V2, определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2.
Графически можно изображать только равновесные процессы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
Дата добавления: 2015-12-16; просмотров: 686;
