Необходимые приборы
1) Бутыль емкостью 5... 6 л. Для определения объема (калибрования) сухую бутыль взвешивают, закрывают пробкой, делают метку на бутыли, заполняют дистиллированной водой до метки и снова взвешивают. Разница между второй и первой массами, выраженная в граммах, составит объем бутыли в миллилитрах (см).
2) Калиброванный флакон емкостью 100...120 мл, вставленный в отверстие пробки калиброванной бутыли.
3) Две бюретки по 50 мл.
4) Нагнетательные меха для наполнения бутыли исследуемым воздухом или насос.
5) Термометр, барометр.
1.1.4 Реактивы
1) Титрованный раствор едкого бария, 1 мл которого может связать 1 мг СО2.
2) Титрованный раствор щавелевой кислоты, 1 мл которого соответствует 1 мг СО2.
3) Индикатор – 1%-ный спиртовой раствор фенолфталеина, который с раствором щелочи дает интенсивный красный цвет; при малейшем же избытке кислоты красный цвет исчезает.
1.1.5 Порядок анализа
1) Установление первого титра баритового раствора.
2)Отбор пробы исследуемого воздуха в бутыль.
3)Поглощение баритовым раствором углекислого газа из исследуемого воздуха, находящегося в бутыли.
4)Определение титра баритового раствора после поглощения углекислого газа.
5)Вычисление полученных результатов.
1.1.6 Ход работы
1) Бюретку, предназначенную для едкого бария, соединяют с бутылью, где хранится баритовый раствор, и заполняют раствором (в системе не должно оставаться ни одного пузырька воздуха).
В колбу или стаканчик наливают 20 мл титрованного раствора щавелевой кислоты и, прибавив три капли индикатора, титруют едким барием до появления слабого розового окрашивания. По объёму баритового раствора, израсходованного на титрование 20 мл щавелевой кислоты, рассчитывают титр баритового раствора.
Пример: на 20 мл щавелевой кислоты израсходовали 21 мл баритового раствора; это количество баритового раствора может связать 20 мл щавелевой кислоты или 20 мг СО2.
Но для исследования берётся 100 мл раствора едкого бария. Поэтому нам необходимо знать титр всего раствора. Расчет проводится по следующей схеме:
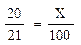
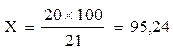
Это означает, что 100 мл исходного титрованного раствора едкого бария могут связать 95,24 мл щавелевой кислоты или 95,24 мг СО2.
2) Калиброванную бутыль ставят в помещение, в котором хотят определить наличие углекислого газа в воздухе. До дна бутыли опускают каучуковую (резиновую) трубку, соединенную с кожаным мехом (насосом) и делают 25...30 вдуваний. Исследуемый воздух вытесняет воздух, находящийся в бутыли, но он не должен загрязняться воздухом, выдыхаемым исследователем. Для этой цели можно использовать автомобильный или какой-либо другой насос. Можно так же налить воды и вылить её из бутыли на месте исследования. Отбор пробы производят на уровне лежания животных. Затем бутыль закрывают пробкой со сквозным отверстием, которое служит для соединения с флаконом, наполненным баритовым раствором (100мл).
3) Большую бутыль надевают на шейку флакона и опрокидывают, при этом баритовый раствор переливается в бутыль. Содержимое бутыли хорошо перемешивают в течение 12...15 минут. Раствор становится мутно-белым, так как происходит поглощение СО2 и образуется нераствори
мый в воде углекислый барий. Затем раствор переливают во флакон, закрывают и дают отстояться, чтобы нерастворимый углекислый барий осел на дно.
Во время работы необходимо измерить температуру воздуха и барометрическое давление, чтобы по формуле Бойля-Мариотта и Гей-Люссака привести объем воздуха, взятого в бутыль для исследования, к нормальным условиям (температура 0°С, давление 760 мм. рт. ст. ):
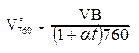
где 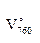 – объём пробы воздуха, приведённый к нормальным условиям,
– объём пробы воздуха, приведённый к нормальным условиям,
см3;
V - объем бутыли, см3;
В – барометрическое давление в момент исследования, мм. рт. ст;
1+ at – поправка на температуру (a - коэффициент теплового расширения воздуха при повышении температуры на 1°С, равный 0, 003663, t - температура воздуха в момент наблюдения, °С).
Для ускорения расчетов пользуются данными таблицы (Приложение А), в которой даны готовые числовые величины для 1+ at и В/760.
4) Приступают к титрованию отстоявшегося баритового раствора после поглощения СО2. В бюретку наливают осветленный баритовый раствор, в стаканчик для титрования – 20 мл щавелевой кислоты и две-три капли индикатора. Титруют так же, как и при определении первого титра баритового раствора.
Предположим, что на титрование 20 мл раствора щавелевой кислоты, в данном случае, израсходовали 26,5 мл раствора Ва(ОН)2. Отсюда рассчитывают второй титр:
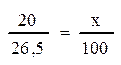
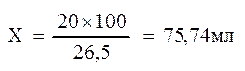
5)Разница между первым и вторым титром равна 19,77 (95,24 – 75,47 = 19,77), то есть в отобранной пробе воздуха содержится 19,77 мг СО2.
6)Для вычисления процентного содержания углекислоты в исследуемом воздухе необходимо привести его объём к нормальным условиям и перевести найденную массу углекислоты в объём.
1 мг углекислоты при нормальных условиях (0°С и 760 мм. рт. ст. ) занимает объем 0,509 см3. Значит 19,77 мг СО2 занимают объём 10,062 см3.
Предположим, что объем бутыли с пробой исследуемого воздуха равен 6000 см3 при температуре воздуха 8°С и давлении 754 мм. рт. ст. Пользуясь формулой Бойля - Мариотта и Гей - Люссака (1), приводим исследуемый объем воздуха к нормальным условиям:
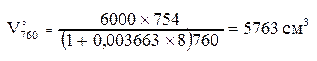
В пересчете на процентное содержание 10,062 см3 углекислоты в исследуемом воздухе составляет:
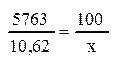
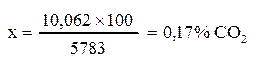
В абсолютных же величинах концентрация углекислого газа составляет:
19,77 мг СО2 / 5,783 л = 3,4186 мг/л или 3,4186 мг СО2 × 1000 = 3418,6
мг/м3.
Контрольные вопросы
1) Источники накопления углекислого газа в животноводческих помещениях.
2) Механизм действия СО2 на организм животных.
3) Принцип определения углекислого газа методом Субботина-Нагорского.
4) Какие реактивы используются при определении углекислого газа?
5) Перечислите приборы и оборудование, необходимые для определения углекислого газа методом Субботина-Нагорского.
6) Для чего и как определяется первый титр раствора едкого бария?
7) Как отбирается проба воздуха?
8) Как провести второе титрование?
9) Что такое «нормальные условия»?
10) Для чего объём пробы воздуха надо приводить к нормальным условиям?
11) Формула Бойля-Мариотта.
12) Для чего используется коэффициент 0,509?
13) Приведите схему расчёта концентрации углекислого газа.
1.2 ОПРЕДЕЛЕНИЕ УГЛЕКИСЛОГО ГАЗА МЕТОДОМ ГЕССА
Для ускорения определения СО2 в воздухе животноводческих помещений можно пользоваться методом Гесса.
1.2.1 Цель занятия. Освоить метод определения углекислого газа по Гессу.
1.2.2 Задачи занятия. Определить концентрацию углекислого газа методом Гесса.
1.2.3 Приборы необходимые для проведения этого метода:
1)круглая плоскодонная калиброванная колба емкостью около 1 л с пробкой (резиновой, корковой или ватно-марлевой);
2)химический стакан или колба ёмкостью 50 мл;
3)две бюретки объёмом 25 – 50 мл и штатив или две пипетки объёмом 10 мл;
4) шары Ричардсона, кожаные меха или насос (велосипедный, мотоциклетный, автомобильный) для отбора проб воздуха;
5) термометр, барометр.
1.2.4 Реактивы
1)Титрованный раствор едкого бария, 1 мл которого может связать 1 мг СО2;
2)Титрованный раствор щавелевой кислоты, 1 мл которого соответствует 1 мг СО2;
3)Индикатор – 1%-ный спиртовой раствор фенолфталеина, который с раствором щелочи дает интенсивный красный цвет; при малейшем же избытке кислоты красный цвет исчезает.
1.2.5 Порядок анализа
1)Установление первого титра баритового раствора;
2)Отбор пробы исследуемого воздуха в колбу;
3)Поглощение баритовым раствором углекислого газа из исследуемого воздуха, находящегося в бутыли;
4)Определение титра баритового раствора после поглощения углекислого газа;
5)Вычисление полученных результатов.
1.2.6 Ход определения
1) Определить титр исходного раствора едкого бария. Для этого в колбу, емкостью 50 мл (стакан для титрования) налить 10 мл раствора едкого бария, добавить I...2 капли индикатора и титровать раствором щавелевой кислоты до исчезновения окраски.
Количество щавелевой кислоты, пошедшее на титрование, разделить на объем раствора бария. Например, на титрование 10 мл едкого бария пошло 9,5 мл раствора щавелевой кислоты, значит, титр раствора едкого бария равен 0,95 (9,5/10 = 0,95).
2)Калиброванную колбу емкостью 1 литр заполнить исследуемым воздухом путем накачивания шарами Ричардсона в течение 1,5...2 минут, налить в нее из бюретки 10 мл раствора едкого бария, закрыть пробкой и проводить поглощение СО2, активно перемешивая содержимое колбы в течение 10...15 минут.
3)Убрать из горловины колбы пробку и закрыть ее листом бумаги с отверстием посередине. Добавить в колбу 1...2 капли 1% раствора фенолфталеина и титровать раствором щавелевой кислоты до обесцвечивания раствора. При этом надо следить, чтобы раствор щавелевой кислоты попадал непосредственно в раствор едкого бария, а не на стенки колбы.
4) Рассчитать концентрацию углекислоты. Для этого из 10 мл раствора Ва(ОН)2 вычесть количество щавелевой кислоты, пошедшей на титрование. Разность умножить на титр исходного раствора едкого бария. Полученная величина показывает количество СО2 в пробе воздуха в миллиграммах. Перевести массу СО2 в объем, учитывая, что 1 мг её при нормальных условиях имеет объём 0,509 см3. Из объёма пробы воздуха вычесть 10 мл (количество влитого в колбу раствора едкого бария). Привести объём пробы воздуха к нормальным условиям, используя формулу Бойля-Мариотта и Гей-Люссака.
Пример расчета: титр раствора едкого бария равен 0,95. На титрование 10 мл такого раствора после поглощения СО2 было израсходовано 7,3 мл раствора щавелевой кислоты. Следовательно, в исследуемой пробе воздуха содержится 2,565 мг СО2. Объём углекислоты будет равен: 2,565 мг СО2 × 0,509 см3 = 1,31 см3. Затем объем взятой пробы воздуха в количестве 1250 мл приводим к нормальным условиям по формуле:
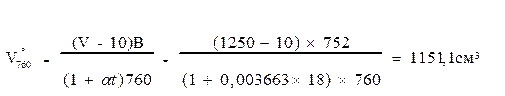
Процентное содержание углекислого газа рассчитаем по пропорции:
1151,1 см3 – 100%
1,31 см3 СО2 – Х
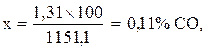
1.2.7 Контрольные вопросы
1) Принцип определения концентрации углекислого газа методом Гесса?
2) Укажите сходство и различие между методами Субботина-Нагорского и Гесса.
3) Почему при приведении объёма пробы воздуха к нормальным условиям из объёма пробы отнимают 10 см3?
4) Какие реактивы используются при определении углекислого газа методом Гесса?
5) Перечислите приборы и оборудование, необходимые для определения углекислого газа методом Гесса.
6) Для чего и как определяется первый титр раствора едкого бария?
7) Как отбирается проба воздуха?
8) Как провести второе титрование?
9) Что такое «нормальные условия»?
10)Для чего объём пробы воздуха надо приводить к нормальным условиям?
11)Формула Бойля-Мариотта.
12)Для чего используется коэффициент 0,509?
13)Приведите схему расчёта концентрации углекислого газа.
Дата добавления: 2015-10-21; просмотров: 4583;
