Миозиновая регуляция
Миозиновая регуляция характерна для гладких мышц.
У гладких мышц нет тропониновой системы, а легкая цепь (р-цепь) миозина подавляет его АТФ-азную активность и препятствует присоединению миозина к F-актину.
В саркоплазме гладких мышц присутствует киназа легких цепей миозина, зависимая от Са2+. При повышении в саркоплазме Са2+, он присоединяется к кальмодулину. Комплекс кальмодулин-4Са2+ активирует киназу легких цепей миозина.
Активная киназа легких цепей миозина фосфорилирует легкую цепь р, которая при этом перестает ингибировать АТФ-азную активность миозина и препятствовать взаимодействию миозина с F-актином. В результате начинается сократительный цикл.
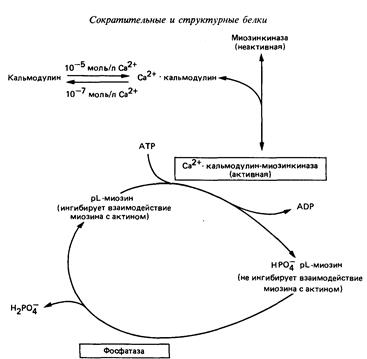
Кальциевая регуляция сокращения гладких мышц (по Р. Марри, 1993).
Расслабление гладких мышц происходит, когда 1) содержание ионов Са2+ в саркоплазме падает ниже 10-7 моль/л; 2) Са2+ отсоединяется от кальмодулина, который в свою очередь отделяется от киназы легкой цепи миозина, вызывая ее инактивацию; 3) нового фосфорилирования легкой цепи р не происходит, и протеинфосфатаза легкой цепи, которая постоянно активна и не зависит от кальция, отщепляет от легкой цепи р ранее присоединившиеся к ней фосфаты; 4) дефосфорилированная легкая цепь р миозина ингибирует связывание миозиновых головок с F-актином и подавляет активность АТФ-азы; 5) миозиновые головки в присутствии ATФ отделяются от F-актина, а повторное их связывание произойти не может из-за присутствия в системе дефосфорилированной легкой цепи р.
Дата добавления: 2015-09-02; просмотров: 1140;
