ПОТЕНЦИОМЕТРИЯ
Потенциометрический метод основан на измерении электродвижущих сил обратимых гальванических элементов и применяется для определения концентрации ионов в растворе.
Метод был разработан в конце прошлого столетия, после того, как в 1889 г. Вальтер Нернст вывел уравнение, связывающее потенциал электрода с активностью (концентрацией веществ):
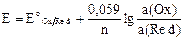 ,
,
где 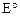 – стандартный электродный потенциал, В; 0,059 – константа, включающая универсальную газовую постоянную (
– стандартный электродный потенциал, В; 0,059 – константа, включающая универсальную газовую постоянную ( 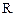 ), абсолютную температуру и постоянную Фарадея (
), абсолютную температуру и постоянную Фарадея (  );
);  – число электронов, принимающих участие в электродной реакции;
– число электронов, принимающих участие в электродной реакции; 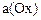 и
и 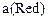 – активность окисленной и восстановленной форм вещества соответственно.
– активность окисленной и восстановленной форм вещества соответственно.
При погружении металлической пластинки в раствор, на границе металл-раствор устанавливается равновесие
Ме 0 ↔ Ме n+ + nē
и возникает электродный потенциал. Измерить этот потенциал нельзя, но можно измерить электродвижущую силу гальванического элемента.
Исследуемый гальванический элемент состоит из двух электродов, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом).
Электрод, потенциал которого зависит от активности определяемых ионов, называется индикаторным: Е= f(с). Электрод, потенциал которого не зависит от концентрации определяемых ионов и остается постоянным называется электродом сравнения. Его применяют для измерения потенциала индикаторного электрода.

| Рис. 9. Прибор для измерения ЭДС гальванического элемента: 1 – электролитическая ячейка с раствором; 2 – индикаторный электрод; 3 – электрод сравнения; 4 – потенциометр. |
ЭДС исследуемого элемента выражается как разность между потенциалом электрода сравнения и потенциалом индикаторного электрода:
Е = Ест. – Еинд. Þ Еинд. = Ест. – Е
При постоянном потенциале Ест., измерив на приборе ЭДС элемента, можно рассчитать потенциал индикаторного электрода.
Для измерения электродвижущей силы применяют систему двух электродов – индикаторного и электрода сравнения.
Классификация электродов.
В соответствии с механизмом возникновения или изменения потенциала электроды классифицируются на металлические, электроды II рода и ионоселективные (мембранные) электроды (рис. 10). Металлические электроды делятся на активные I рода и индифферентные:







Рис. 10. Классификация индикаторных электродов
Требования к индикаторным электродам
1. Равновесный потенциал электрода должен устанавливаться быстро;
2. Электрод должен быть обратим (потенциал изменяется с изменением концентрации определяемого вещества). Свойство обратимости присуще не всем электродам (Al покрывается окисной пленкой, нельзя использовать электроды из Fe, Cr…);
3. Электрод должен обладать воспроизводимостью;
4. Электрод должен обладать химической устойчивостью (например, Zn – электрод не пригоден в кислой среде, т.к. металл растворяется в кислоте).
Активные металлические электроды I рода. Представляет собой металлическую пластину или проволоку, погруженную в раствор хорошо растворимой соли этого металла. Например, серебряная проволока, погруженная в раствор нитрата серебра (рис. 11).

| Рис. 11. Серебряный электрод. |
На поверхности электрода возникает двойной электрический слой, и устанавливается равновесный потенциал Е, который зависит от активности ионов Ag+ в растворе:
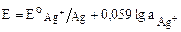
К катионобменным электродам относятся медный, ртутный, серебряный, кадмиевый, амальгамные электроды (раствор металла в ртути, к амальгамным электродам относятся цинковый, свинцовый).
Металлические индифферентные электроды не участвуют в электрохимической реакции, а только обеспечивают перенос электронов для окислительно-восстановительной реакции, протекающей в растворе. Такие электроды представляют собой проволоку, пластину или сетку, изготовленную из инертных металлов (платина, золото, палладий), а также графит, погруженные в раствор, содержащий сопряженную редокс-пару. Потенциал такого электрода зависит от активности окисленной и восстановленной форм данной редокс-пары. Например, редокс-потенциал платинового электрода, погруженного в раствор, содержащий Fe+3 и Fe+2:

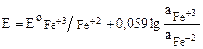 .
.
Электроды II рода представляют системы, в которых металл электрода покрыт труднорастворимой солью этого металла и находится в растворе, содержащем хорошо растворимую соль с теми же анионами. Эти электроды обратимы относительно анионов, их потенциал зависит от активности анионов труднорастворимого соединения, входящего в состав электрода. Электроды II рода применяются, как правило, в качестве электродов сравнения (потенциал таких электродов при измерениях остается постоянным).
К электродам II рода относится хлоридсеребряный электрод. Он представляет собой серебряную проволоку, покрытую труднорастворимой солью AgCl и погруженную в насыщенный раствор хорошо растворимой соли с одноименным анионом – KCl (рис. 12).
Потенциал электрода зависит от активности (концентрации) хлорид-ионов в растворе:
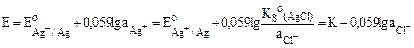 ,
,
где 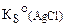 – произведение растворимости хлорида серебра;
– произведение растворимости хлорида серебра;  .
.

| Рис. 12. Хлоридсеребряный электрод: 1 – серебряная проволока; 2 – AgCl; 3 – насыщенный раствор KCl; 4 – дренаж (асбестовое волокно) |
Потенциал электрода при измерениях остается постоянным и не зависит от состава анализируемого раствора, т. к. внутренний раствор KCl насыщен, и концентрация Cl– не изменяется. Если внутренний раствор KCl ненасыщен, электрод применяется как индикаторный для определения концентрации Cl–.
Ионоселективные электроды (ИСЭ) – сенсоры (чувствительные элементы, датчики), потенциал которых линейно зависит от lg а определяемого иона в растворе. Важнейшей составной частью ИСЭ является полупроницаемая мембрана, способная пропускать только определенные ионы. Мембраны изготавливаются из специальных сортов стекла, монокристаллов, органических полимеров, пленок ферментов, жидких ионообменников. На границе мембрана – раствор устанавливается равновесие обмена ионами и возникает разность потенциалов. Потенциал ИСЭ зависит от активности определяемого иона в анализируемом растворе а1и во внутреннем растворе электрода а2:
 .
.
Важной характеристикой ИСЭ является потенциометрический коэффициент селективности, показывающий во сколько раз электрод более чувствителен к определяемым ионам, чем к посторонним. Коэффициент селективности (К) характеризует способность мембраны различать ионы. Чем меньше К, тем выше селективность. Например, коэффициент селективности рNа электрода 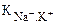 = 10–3. Это значит, что электрод в 1000 раз чувствительнее к ионам натрия, чем к ионам калия. Для хороших стеклянных электродов:
= 10–3. Это значит, что электрод в 1000 раз чувствительнее к ионам натрия, чем к ионам калия. Для хороших стеклянных электродов:  = 10–12;
= 10–12; 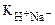 = 10–13.
= 10–13.
Наибольшее применение находит стеклянный электрод, селективный на Н+ (рН–стеклянный электрод). В 1909 г. он был предложен Ф. Габером для определения рН.
Он представляет собой тонкостенный стеклянный шарик (рис. 13), заполненный стандартным 0,1 моль/дм3 раствором HCl или буферным раствором. Внутренний электрод – серебряная проволока, покрытая труднорастворимой солью AgCl. Устройство закрыто защитной трубкой. Мембрана изготовлена из алюмосиликатного стекла с массовой долей до 22 % Na2O, 72 % SiO2 и 6 % CaO.
Высокое содержание Na+ в мембране способствует обмену ионами Na+ мембраны и Н+ из раствора; на поверхности электрода устанавливается равновесие: Na+стекло↔ Н+раствор. За счет различия концентрации ионов Н+ по обе стороны от мембраны возникает двойной электрический слой и ЭДС: Н+раствор↔ Н+стекло.
Потенциал стеклянного электрода зависит от активности (концентрации) ионов Н+ в растворе:
 ,
,
где 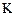 – константа, зависящая от сорта стекла и устройства электрода.
– константа, зависящая от сорта стекла и устройства электрода.
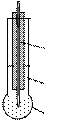
| Рис. 13. Стеклянный электрод: 1 – мембрана; 2 – стандартный раствор HCl; 3 – хлоридсеребряный электрод |
Преимущества рН-стеклянного электрода: электрохимическое равновесие устанавливается мгновенно; не адсорбирует поверхностно-активные вещества; применим в широком диапазоне рН; отсутствует влияние окислителей и восстановителей на работу электрода. Недостатки электрода: не рекомендуется применение при рН > 10 (нарушаются функции электрода), в присутствии плавиковой кислоты (стекло растворяется), кроме того, такой электрод весьма хрупок, что создает известные затруднения при его использовании.
С другим составом стекла электроды селективны на другие ионы. Например, в аналитической практике применяются рNa–, pK–, pLi–, pAg–, pCa–, pMg–, pBa–, pNH4–, рNО3–, рСl– стеклянные электроды.
Электрод с кристаллической мембраной представляет собой трубку, на конце которой находится мембрана из малорастворимого кристаллического вещества с ионным характером проводимости. Трубка заполнена раствором сравнения (0,1 М раствор определяемого иона и КСl), рис. 14. Электродом сравнения служит хлоридсеребряный электрод. Мембрана изготовлена из сульфида серебра Аg2S (сульфидный электрод) или фторида лантана – LaF3 (фторидный). Электрод применяется для определения ионов F–, Ag+, S2– ,Cl–, Br–, J– и т.д.

| Рис. 14. ИСЭ с кристаллической мембраной: 1– мембрана; 2 – раствор сравнения; 3 – хлоридсеребряный электрод |
Электрод с жидкой мембраной. Хлоридсеребряный электрод погружен в раствор хорошо растворимой соли хлорида определяемого катиона (рис. 15). Исследуемый раствор отделен от раствора сравнения тонким слоем жидкого ионита. Электроды применяются для определения Са2+, К+, Nа+, NН4+ и т.д.

| Рис. 15. ИСЭ с жидкой мембраной: 1 – хлоридсеребряный электрод; 2 – раствор МеCl2; 3 – ионит; 4 – дренаж |
Потенциометрический анализ. Различают два вида потенциометрического анализа:
Дата добавления: 2015-10-19; просмотров: 2285;
