Катаболизм белков.
Белки, входящие в составклеток организма, также подвергаются постоянному распаду под влиянием внутриклеточных протеолитических ферментов, называемыхвнутриклеточными протеиназамиили катепсинами. Эти ферменты локализованы в специальных внутриклеточных органоидах - лизосомах. Мембраны, окружающие лизосомы, непроницаемы для катепсинов, но зато пропускают во внутрь лизосом белки, подлежащие протеолизу. По своему действию катепсины похожи на ферменты желудочного и поджелудочного соков: катепсины вызывают превращение белков в олигопептиды, которые легко выходят из лизосом в цитоплазму клеток и превращаются там в аминокислоты. Такой распад протекает с участием цитоплазматических ферментов, аналогичных ферментам кишечного сока.
В последние годы в цитоплазме клеток организма обнаружены особые белковые мультиферментные комплексы, названные протеасомами. Протеасомы предназначены для избирательного расщепления белков, которых не должно быть в клетках. Такому превращению подвергаются чужеродные и дефектные белки, а также регуляторные белки, присутствие которых ограничено во времени (например, белки – гормоны, белки – регуляторы транскрипции).
Для предупреждения чрезмерного распада собственных белков в организме имеются особые белки – эндогенные ингибиторы протеиназ, снижающие скорость протеолиза. Особенно много таких ингибиторов протеолиза в богатой белками плазме крови.
В сутки внутриклеточному протеолизу подвергается 200-300 г собственных белков организма, что приводит к возникновению примерно такого же количества аминокислот.
Важно отметить, что при распаде как пищевых, так и собственных белков организма образуются аминокислоты одних и тех же 20 видов.Поэтому в течение суток в организме появляется около 300-400 г свободных аминокислот.
Глубокий распад белков, сопровождающийся расщеплением всех пептидных связей и приводящий к образованию аминокислот, называется тотальным протеолизом.
В некоторых случаях под действием протеолитических ферментов в молекуле белка избирательно расщепляется лишь одна пептидная связь между строго определенными аминокислотами и от белка отщепляется часть его молекулы – полипептид. Такой распад белков получил название ограниченный протеолиз. Примером ограниченного протеолиза является превращение проферментов в ферменты (например, активация протеолитических ферментов, участвующих в пищеварении; переход факторов свертывания крови из неактивной формы в активную).
9.3.Синтез белков
Бόльшая часть аминокислот используется для синтеза белков. В организме взрослого человека существует равновесие между распадом и синтезом белков. У детей преобладает синтез, ведущий к накоплению белков в организме, что является обязательным условием роста и развития организма.
Синтез белков происходит при обязательном участии нуклеиновых кислот.
Первый этап синтеза белка - транскрипция осуществляется в клеточном ядре с использованием ДНК как источника генетической информации. Генетическая (наследственная) информация обусловливает порядок расположения аминокислот в полипептидных цепях синтезируемого белка. Эта информация закодирована строгой последовательностью азотистых оснований в молекуле ДНК. Каждая аминокислота кодируется сочетанием трех азотистых оснований, называемым кодоном или триплетом. Участок молекулы ДНК, содержащий информацию об определенном белке, получил название ген. На этом участке ДНК во время транскрипции по принципу комплементарностисинтезируется информационная РНК (иРНК), Эта нуклеиновая кислота представляет собой копию соответствуюшего гена. Следовательно, иРНК содержит информацию о строении белка, закодированного в данном гене. Образовавшаяся иРНК выходит из ядра и поступает в рибосомы.
Аналогичным образом на ДНК как на матрице происходит синтез рибосомных (рРНК) и транспортных (ТРНК) РНК.
В ходе второго этапа – рекогниции (распознования), протекающего в цитоплазме, аминокислоты избирательно связываются со своими переносчиками - транспортными РНК (ТРНК).
Все тРНК (их обнаружено около 60) построены сходным образом. Молекула каждой тРНК представляет собой короткую полинуклетидную цепь, содержащую примерно 80 нуклеотидов и частично закрученную в двойную спираль, что приводит к возникновению пространственной конфигурации «изогнутого клеверного листа» (рис.1).
На одном конце полинуклеотидной цепи у всех тРНК находится нуклеотид, содержащий аденин. К этому концу молекулы тРНК присоединяется аминокислота. Петля, противоположная месту присоединения аминокислоты, содержит антикодон, состоящий из трех азотистых оснований и предназначенный для последующего связывания с комплементарным кодоном иРНК. Одна из из боковых петель молекулы тРНК. обеспечивает присоединение тРНК к ферменту, участвующему в рекогниции, а другая боковая петля необходима для присоединения тРНК рибосоме на следующем этапе синтеза белка.
На этом этапе в качестве источника энергии используется молекула АТФ. В результате рекогниции образуется комплекс аминокислота-тРНК (аминоацил-ТРНК):
 АМИНОКИСЛОТА + тРНКАМИНОАЦИЛ-тРНК
АМИНОКИСЛОТА + тРНКАМИНОАЦИЛ-тРНК
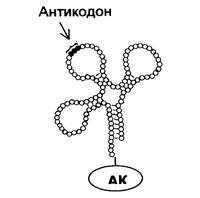
Рис. 1 Схема строения аминоацил-тРНК
В составе этого комплекса аминокислота обладает повышенной химической активностью. В связи с этим второй этап синтеза белка часто называют активацией аминокислот.
Третий этап синтеза белка- трансляция происходит на рибосомах. Каждая рибосома состоит из двух частей – большой и малой субчастиц. По химическому составу обе субчастицы представляют собою нуклеопротеиды, состоящие из рибосомных РНК и белков. Рибосомы способны легко распадаться на субчастицы (диссоциация), которые снова могут соединяться друг с другом, образуя рибосому (ассоциация).
Трансляция начинается с диссоциации рибосомы на субчастицы, которые сразу же присоединяются к начальной части молекулы информационной РНК, поступающей из ядра. При этом между субчастицами остается пространство (так называемый «туннель»), гдерасполагается небольшой участок иРНК.
Затем к образовавшемуся комплексу рибосома-иРНК присоединяются тРНК, связанные с аминокислотами. Присоединение тРНК к этому комплексу происходит путем связывания одной из боковых петлей тРНК с рибосомой и связывания антикодона тРНК с комлементарным ему кодоном иРНК, находящимся в туннеле между субчастицами рибосомы. Одновременно к комплексу рибосома-иРНК могут присоединиться только две тРНК с аминокислотами.
Благодаря специфическому связыванию антикодонов тРНК с кодонами иРНК, к участку молекулы иРНК, находящемуся в туннеле, присоединяются только молекулы тех тРНК, у которых антикодоны комлементарны кодонам иРНК. Поэтому эти тРНК доставляют в рибосомы только строго определенные аминокислоты. Далее аминокислоты соединяются друг с другом пептидной связью и образуется дипептид, который связан с одной из тРНК. После этого рибосома передвигается вдоль иРНК ровно на один кодон (это перемещение рибосомы называется транслокацией).
В результате транслокации свободная (без аминокислоты) тРНК отщепляется от рибосомы, а в зоне туннеля появляется новый кодон, к которому присоединяется по принципу комплементарности еще одна тРНК с аминокислотой, соответствующей этому кодону. Доставленная аминокислота соединяется с ранее образовавшимся дипептидом, что приводит к удлинению пептидной цепи. Далее следуют новые транслокации, поступление на рибосому новых тРНК с аминокислотами и дальнейшее удлинение пептидной цепи.
Таким образом порядок включения аминокислот в синтезируемый белок определяется последовательностью кодонов в иРНК.
Завершается синтез полипептидной цепи при поступлении в туннель особого кодона, который не кодирует аминокислоты и к которому не может присоединиться ни одна тРНК. Такие кодоны называются терминирующими или нонсенс-кодонами. Особенно велика их роль в синтезе белков, молекула которых состоит из нескольких полипептидов.
В конечном итоге, за счет описанных трех этапов синтезируются полипептиды, т.е. формируется первичная структура белка. Высшие (пространственные) структуры (вторичная, третичная, четвертичная) возникают самопроизвольно. Это объясняется тем, что пространственные структуры фиксируются, в основном, химическими связями, возникающими между радикалами аминокислот. Поэтому в каждом белке эти связи образуются специфически в соответствии с генетически обусловленной последовательностью расположения радикалов в полипептидных цепях.
В некоторых случаях полипептидная цепь после завершения синтеза подвергается незначительной химической модификации, в результате чего в ней появляются некодируемые аминокислоты (не относящиеся к 20 обычным аминокислотам). Например, при синтезе белка коллагена на рибосомах образуется его предшественник – проколлаген, содержащий в большом количестве аминокислоты лизин и пролин. Эти аминокислоты, находящиеся в составе полипептидной цепи, подвергаются в ходе модификации окислению и превращаются соответственно в оксилизин и оксипролин, что приводит к переходу проколлагена в коллаген.
Синтез белков - процесс энергоемкий. Для включения в молекулу синтезируемого белка только одной аминокислоты требуется не менее 3 молекул АТФ.
В очень небольших количествах белки еще синтезируются в митохондриях, где также имеются ДНК, и-РНК, т-РНК и рибосомы.
Синтез белков в организме ускоряется соматотропным гормоном (гормоном роста) и тестостероном (мужским половым гормоном). Тормозится синтез белков гормонами коры надпочечников – глюкокортикоидами. Регулирующее действие всех этих гормонов связано с их влиянием на скорость транскрипции.
Синтез белков подавляют многие антибиотики, ингибирующие трансляцию.
Дата добавления: 2015-10-19; просмотров: 1485;
