Процессинг эукариотических мРНК
Созревание, или процессинг, м-РНК предполагает модифицирование первичного транскрипта и удаление из него некодирующих интронных участков с последующим соединением (сплайсингом) кодирующих последовательностей — экзонов. Модифицирование первичного транскрипта эукариотической м-РНК начинается вскоре после синтеза его 5'-конца, содержащего одно из пуриновых оснований (аденин или гуанин). На этом конце образуется колпачок — кэп. Образуемые на 5' -концах м-РНК кэпы обеспечивают узнавание молекул м-РНК малыми субчастицами рибосом в цитоплазме. Кэпирование осуществляется еще до окончания синтеза первичного транскрипта. 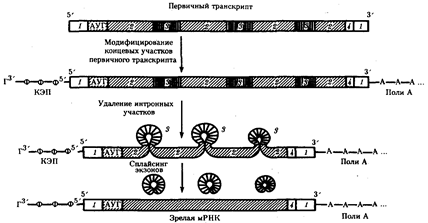
Образование зрелой мРНК эукариот в ходе процессинга:
1 — некодирующие последовательности, 2 — экзоны, 3 — интроны, 4 — кодон-терминатор
После завершения транскрипции происходит удаление части нуклеотидов на 3'-конце первичного транскрипта и присоединение к нему последовательности, состоящей из 100—200 остатков адениловой кислоты (полиА). Считают, что эта последовательность способствует дальнейшему процессингу и транспорту зрелой м-РНК из ядра. После выхода м-РНК в цитоплазму ее полиА-последовательность постепенно укорачивается под действием ферментов, отщепляющих нуклеотиды на 3'-конце. Таким образом, по длине полиА-последовательности можно косвенно судить о времени пребывания м-РНК в цитоплазме. Возможно, добавление полиА-последовательности в ходе процессинга повышает стабильность м-РНК. Однако около трети м-РНК вообще не содержат полиА-участка. К ним относятся, например, гистоновые м-РНК.
Образование кэпа на 5'-конце и полиА-последовательности на 3'-конце характерно только для процессинга РНК, синтезируемых РНК-полимеразой II. Кроме метилирования при формировании кэпов в мРНК высших эукариот происходит метилирование небольшой части внутренних нуклеотидов с частотой приблизительно одно на тысячу оснований м-РНК.
Наряду с модифицированием м-РНК эукариот процессинг предполагает удаление из первичных транскриптов неинформативных для данного белка интронных участков, размер которых варьирует от 100 до 10 000 нуклеотидов и более. На долю интронов приходится около 80% всей гя-РНК. Удаление интронов с последующим соединением экзонных участков называют сплайсингом.
Сплайсинг представляет собой механизм, который должен обеспечивать удаление из первичного транскрипта строго определенных интронных участков. Нарушение этого процесса может привести к сдвигу рамки считывания при трансляции и невозможности синтеза нормального пептида. Закономерность вырезания интронов, очевидно, обеспечивается благодаря наличию на их концах специфических нуклеотидных последовательностей, служащих сигналами для сплайсинга.
В настоящее время описано несколько вероятных механизмов сплайсинга, обеспечивающих точность этого процесса. Возможно, она достигается действием каких-то ферментов, специфически узнающих концевые участки интронов и катализирующих разрыв фосфодиэфирных связей на границе экзон — интрон, а затем образование связей между двумя экзонами.
Установлено активное участие в сплайсинге особых малых ядерных РНК (мя-РНК), образующих комплексы с белками (мя-РНП). Очевидно, мя-РНК своими нуклеотидными последовательностями комплементарно взаимодействуют с концевыми участками интронов, которые образуют при этом замкнутые петли. Расщепление РНК в устье интронной петли приводит к удалению неинформативной последовательности и соединению (сплайсингу) сближенных концов экзонов.
Обсуждается также автокаталитическая способность РНК-транскрипта к сплайсингу. Описанные способы сплайсинга свидетельствуют об отсутствии универсального механизма этого процесса, однако во всех случаях достигается точное удаление интронов с образованием определенной м-РНК, обеспечивающей синтез необходимого клетке белка.
В настоящее время доказана возможность альтернативного (взаимоисключающего) сплайсинга, при котором из одного и того же первичного транскрипта могут удаляться разные нуклеотидные последовательности и образовываться разные зрелые м-РНК. В результате одна и та же последовательность нуклеотидов ДНК может служить информацией для синтеза разных пептидов. Альтернативный сплайсинг, вероятно, очень характерен в системе генов иммуноглобулинов у млекопитающих, где он позволяет формировать на основе одного транскрипта мРНК для синтеза разных видов антител.
Благодаря преобразованиям, происходящим с РНК-транскриптом в ходе процессинга, зрелые м-РНК эукариот характеризуются большей стабильностью по сравнению с прокариотическими м-РНК.
По завершении процессинга зрелая м-РНК проходит отбор перед выходом в цитоплазму, куда попадает всего 5% гя-РНК. Остальная часть расщепляется, не покидая ядра.
Таким образом, преобразования первичных транскриптов эукариотических генов, обусловленные их экзон-итронной организацией и необходимостью перехода м-РНК из ядра в цитоплазму, определяют особенности реализации генетической информации в эукариотической клетке.
4.6. Трансляция– процесс синтеза белка на рибосомах, направляемый матрицей и-РНК.
Аминокислоты, из которых синтезируются белки, доставляются к рибосомам с помощью специальных транспортных РНК (т-РНК).
Молекулы т-РНК представляют собой полинуклеотидные цепи, синтезируемые на определенных последовательностях ДНК. Они состоят из относительно небольшого числа нуклеотидов —75-95. В результате комплементарного соединения оснований, которые находятся в разных участках полинуклеотидной цепи т-РНК, она приобретает структуру, напоминающую по форме лист клевера.
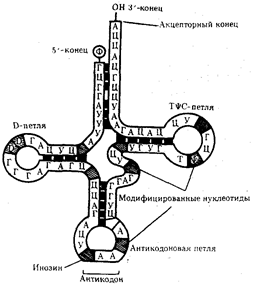
Строение типичной молекулы т-РНК
В ней выделяют четыре главные части, выполняющие различные функции.Акцепторный «стебель» образуется двумя комплементарно соединенными концевыми частями т-РНК. Он состоит из семи пар оснований. 3'-конец этого стебля несколько длиннее и формирует одноцепочечный участок, который заканчивается последовательностью ЦЦА со свободной ОН-группой. К этому концу присоединяется транспортируемая аминокислота. Остальные три ветви представляют собой комплементарно спаренные последовательности нуклеотидов, которые заканчиваются неспаренными участками, образующими петли. Средняя из этих ветвей — антикодоновая — состоит из пяти пар нуклеотидов и содержит в центре своей петли антикодон. Антикодон — это три нуклеотида, комплементарные кодону м-РНК, который шифрует аминокислоту, транспортируемую данной т-РНК к месту синтеза пептида. Между акцепторной и антикодоновой ветвями располагаются две боковые ветви.
На конце одной из двойных спиралей располагается транспортируемая аминокислота, на конце другой — антикодон. Эти участки оказываются максимально удаленными друг от друга. Стабильность третичной структуры т-РНК поддерживается благодаря возникновению дополнительных водородных связей между основаниями полинуклеотидной цепи, находящимися в разных ее участках, но пространственно сближенных в третичной структуре. Установлено также существование нескольких видов т-РНК, способных соединяться с одним и тем же кодоном. В результате в цитоплазме клеток встречается не 61 (по количеству кодонов), а около 40 различных молекул т-РНК. Этого количества достаточно, чтобы транспортировать 20 разных аминокислот к месту сборки белка.
Наряду с функцией точного узнавания определенного кодона в м-РНК молекула т-РНК осуществляет доставку к месту синтеза пептидной цепи строго определенной аминокислоты, зашифрованной с помощью данного кодона. Специфическое соединение тРНК со «своей» аминокислотой протекает в два этапа и приводит к образованию соединения, называемого аминоацил-т-РНК.
4 стадии:
1) Стадия активации аминокислот. Аминокислота активируется, взаимодействуя своей карбоксильной группой с АТФ. В результате образуется аденилированная аминокислота, которая присоединяется к т-РНК с помощью аминоацил-т-РНК-синтетазы.
2) Инициация.На этом этапе происходит сборка всего комплекса, участвующего в синтезе молекулы белка. Последовательно объединяются м-РНК, малая субъединица рибосомы, первая т-РНК со своей аминокислотой, специальные ферменты, называемые факторами инициации, и большая субъединица рибосомы.
В рибосомах имеется две бороздки. Одна из них удерживает растущую полипептидную цепь, другая — м-РНК. Кроме того, в рибосомах выделяют два участка, связывающих т-РНК. В аминоацильном, А-участке размещается аминоацил-т-РНК, несущая определенную аминокислоту. В пептидильном, П-участке располагается обычно т-РНК, которая нагружена цепочкой аминокислот, соединенных пептидными связями. Образование А- и П-участков обеспечивается обеими субчастицами рибосомы.
В каждый момент рибосома экранирует сегмент м-РНК протяженностью около 30 нуклеотидов. При этом обеспечивается взаимодействие только двух т-РНК с двумя расположенными рядом кодонами мРНК.
Фаза инициации, или начало синтеза пептида, заключается в объединении двух находящихся до этого порознь в цитоплазме субчастиц рибосомы на определенном участке м-РНК и присоединении к ней первой аминоацил-т-РНК. Этим задается также рамка считывания информации, заключенной в м-РНК.
В молекуле любой м-РНК вблизи ее 5'-конца имеется участок, комплементарный р-РНК малой субчастицы рибосомы и специфически узнаваемый ею. Рядом с ним располагается инициирующий стартовый кодон АУГ, шифрующий аминокислоту метионин. Малая субчастица рибосомы соединяется с м-РНК таким образом, что стартовый кодон АУГ располагается в области, соответствующей П-участку. При этом только инициирующая т-РНК, несущая метионин, способна занять место в недостроенном П-участке малой субчастицы и комплементарно соединиться со стартовым кодоном. После описанного события происходит объединение большой и малой субчастиц рибосомы с образованием ее пептидильного и аминоацильного участков.
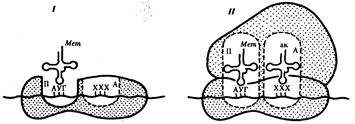
Инициация белкового синтеза:
К концу фазы инициации П-участок занят аминоацил-т-РНК, связанной с метионином, тогда как в А-участке рибосомы располагается следующий за стартовым кодон.
Описанные процессы инициации трансляции катализируются особыми белками — факторами инициации, которые подвижно связаны с малой субчастицей рибосомы. По завершении фазы инициации и образования комплекса рибосома — м-РНК — инициирующая аминоацил-т-РНК эти факторы отделяются от рибосомы.
3) Элонгация– удлинение пептида. Включает в себя все реакции от момента образования первой пептидной связи до присоединения последней аминокислоты. Она представляет собой циклически повторяющиеся события, при которых происходит специфическое узнавание аминоацил-т-РНК очередного кодона, находящегося в А-участке, комплементарное взаимодействие между антикодоном и кодоном.
Благодаря особенностям трехмерной организации т-РНК при соединении ее антикодона с кодоном м-РНК транспортируемая ею аминокислота располагается в А-участке, поблизости от ранее включенной аминокислоты, находящейся в П-участке. Между двумя аминокислотами образуется пептидная связь, катализуемая особыми белками, входящими в состав рибосомы. В результате предыдущая аминокислота теряет связь со своей т-РНК и присоединяется к аминоацил-тРНК, расположенной в А-участке. Находящаяся в этот момент в П-участке т-РНК высвобождается и уходит в цитоплазму.
Перемещение т-РНК, нагруженной пептидной цепочкой, из А-участка в П-участок сопровождается продвижением рибосомы по м-РНК на шаг, соответствующий одному кодону. Теперь следующий кодон приходит в контакт с А-участком, где он будет специфически «опознан» соответствующей аминоацил-тРНК, которая разместит здесь свою аминокислоту. Такая последовательность событий повторяется до тех пор, пока в А-участок рибосомы не поступит кодон-терминатор, для которого не существует соответствующей т-РНК.
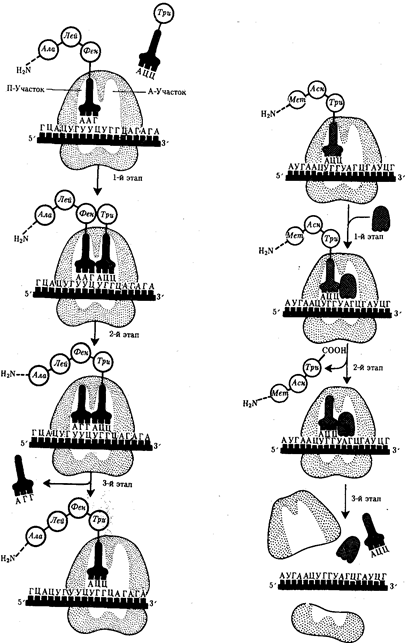
| Стадия элонгации в синтезе белка: 1-й этап — аминоацил-тРНК присоединяется к кодону, расположенному в А-участке; 2-й этап — между аминокислотами, расположенными в А- и П-участках, образуется пептидиая связь: тРНК, расположенная в П-участке, освобождается от своей аминокислоты и покидает рибосому; 3-й этап — рибосома перемещается по мРНК на один кодон так, что тРНК, нагруженная пептидной цепочкой, переходит из А-участка в П-участок; свободный А-участок может быть занят соответствующей аминоацил-тРНК | Терминация синтеза пептидной цепи: 1-й этап — присоединение фактора освобождения к стоп-кодону; 2-й этап — терминация, высвобождение завершенного пептида; 3-й этап — диссоциация рибосомы на две субчастицы |
Сборка пептидной цепи осуществляется с достаточно большой скоростью, зависящей от температуры. У бактерий при 37 °С она выражается в добавлении к полипептиду от 12 до 17 аминокислот в 1 с. В эукариотических клетках эта скорость ниже и выражается в добавлении двух аминокислот в 1 с.
4) Терминация– завершение синтеза полипептида. Связана с узнаванием специфическим рибосомным белком одного из терминирующих кодонов (УАА, УАГ или УГА), когда тот входит в зону А-участка рибосомы. При этом к последней аминокислоте в пептидной цепи присоединяется вода, и ее карбоксильный конец отделяется от тРНК. В результате завершенная пептидная цепь теряет связь с рибосомой, которая распадается на две субчастицы.
Посттрансляционные преобразования белков. Синтезированные в ходе трансляции пептидные цепи на основе своей первичной структуры приобретают вторичную и третичную, а многие — и четвертичную организацию, образуемую несколькими пептидными цепями. В зависимости от функций, выполняемых белками, их аминокислотные последовательности могут претерпевать различные преобразования, формируя функционально активные молекулы белка.
Многие мембранные белки синтезируются в виде пре-белков, имеющих на N-конце лидерную последовательность, которая обеспечивает him узнавание мембраны. Эта последовательность отщепляется при созревании и встраивании белка в мембрану. Секреторные белки также имеют на N-конце лидерную последовательность, которая обеспечивает их транспорт через мембрану.
Некоторые белки сразу после трансляции несут дополнительные аминокислотные про-последовательности, определяющие стабильность предшественников активных белков. При созревании белка они удаляются, обеспечивая переход неактивного пробелка в активный белок. Например, инсулин вначале синтезируется как пре-проинсулин. Во время секреции пре-последовательность отщепляется, а затем проинсулин подвергается модификации, при которой из него удаляется часть цепи и он превращается в зрелый инсулин. Формируя третичную и четвертичную организацию в ходе посттрансляционных преобразований, белки приобретают способность активно функционировать, включаясь в определенные клеточные структуры и осуществляя ферментативные и другие функции.
Дата добавления: 2015-10-09; просмотров: 4682;
