Определить абсолютные значения электродных потенциалов невозможно. Их можно только сравнивать.
В качестве электрода сравнения используется так называемый водородный электрод (рис.2),потенциал которого при стандартных условиях

|
| Рис.2 Схема водородного электрода |
(р=101,325КПа; Т=298К; активность ионов в растворе 1моль/л) принят равным нулю. Газообразный водород не проводит электрического тока, но, адсорбируясь на платиновой поверхности в кислой среде, образует электрод, аналогичный металлическому. Водород в виде ионов переходит в раствор, и устанавливается равновесие
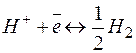 .
.
При измерении электродных потенциалов металлов составляют гальванический элемент из водородного электрода сравнения (анод) и исследуемого металлического электрода (катод) при стандартных условиях. Измеряемая в этом случае ЭДС гальванического элемента
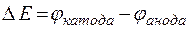 (
( 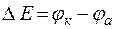 )
)
при 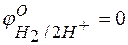 отвечает стандартному электродному потенциалу металла
отвечает стандартному электродному потенциалу металла 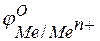 .
.
Стандартные электродные потенциалы металлов сведены в таблицу (ряд напряжений) (см. табл. 5). При значениях активностей, отличных от 1 моль/л, равновесные электродные потенциалы рассчитываются по уравнению Нернста:
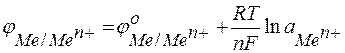 ,
,
где: аМеп+ – активность ионов металла в растворе;
R – универсальная газовая постоянная.
При небольших концентрациях растворов, применяемых в лабораториях, активность можно заменить концентрацией и после подстановки значений констант и параметров получить расчетное уравнение в виде
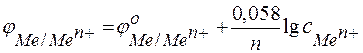 .
.
Зависимость электродных потенциалов от концентрации широко используют для определения многих важнейших констант: произведения растворимости, константы нестойкости, ионного произведения воды, рН водных растворов. Для этих целей используют концентрационные цепи, в которых материал электродов одинаков, а отличны лишь концентрации растворов электролитов, содержащих соответствующие катионы. Например:
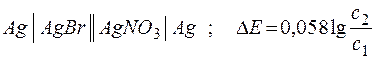 ;
;
с1 < с2 ; 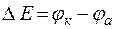 .
.
Можно построить совершенно аналогичную окислительно-восстановительную цепь с участием только ионов в каждом из процессов окисления и восстановления, при этом электроды инертные, а продукты реакции остаются в растворе и не выделяются на электродах. Например, в гальваническом элементе типа
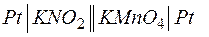
переход электронов осуществляется от электрода с KNO2 к электроду с KMnO4, о чем свидетельствует измеритель напряжения. Для того чтобы составить уравнение электродной реакции, можно воспользоваться электронно-ионным способом, включая в уравнение только участвующие в реакции ионы, которые образуются при диссоциации сильного электролита, и молекулы слабых электролитов, в том числе воды. Уравнивание следует производить путем прибавления или отнятия молекул воды (ионов ОН– или Н+ для щелочной или кислой среды соответственно).
В приведенном примере анодом будет электрод с NO2–, а катодом – электрод с MnO4– в водном растворе. Поэтому реакция окисления на аноде записывается в виде
NО2– + Н2О – 2е 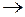 NО3– + 2Н+,
NО3– + 2Н+,
реакция восстановления на катоде принимает вид
MnO4 –+ 8Н+ + 5е 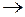 Mn2+ + 4 Н2О.
Mn2+ + 4 Н2О.
Суммирование обеих полуреакций с учетом баланса электронов дает уравнение реакции в ионном виде:
| 2 | MnO4 –+ 8Н+ + 5е 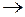 Mn2+ + 4 Н2О Mn2+ + 4 Н2О
| |
| 5 | NО2– + Н2О – 2е 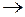 NО3– + 2Н+ NО3– + 2Н+
|
2MnO4 – + 6Н+ + 5NО2– 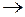 2Mn2+ + 3 Н2О + 5NО3–
2Mn2+ + 3 Н2О + 5NО3–
или в молекулярном виде:
5KNО2 + 2KMnO4 + 3Н2 SO4 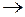 5KNО3 + 2MnSO4 + K2SO4 + 3 Н2О
5KNО3 + 2MnSO4 + K2SO4 + 3 Н2О
Величина потенциала каждого электрода может быть определена его сравнением с водородным электродом. Так как окислительно-восстановительные потенциалы зависят от концентраций, то такое сравнение принято проводить при концентрациях окисленной и восстановленной форм, равных 1 моль/л. В таблице стандартных окислительно-восстановительных потенциалов приводятся только потенциалы восстановления (для окислителя):
| MnO4 –+ 8Н+ + 5е® Mn2+ + 4Н2О; | 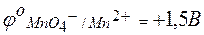
|
| NО2– + Н2О – 2е ® NО3– + 2Н+; | 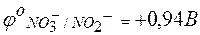
|
Электродная реакция, характеризующаяся меньшей величиной потенциала, определяет восстановитель и переписывается в обратном направлении; при этом знак потенциала меняется на обратный. Суммируя электродные потенциалы, можно определить величину ЭДС элемента, положительное значение которой подтверждает возможность самопроизвольного протекания реакции. По найденной величине 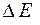 можно рассчитать
можно рассчитать 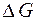 и по уравнению изотермы Вант-Гоффа определить константу равновесия К, величина которой однозначно характеризует глубину протекания процесса.
и по уравнению изотермы Вант-Гоффа определить константу равновесия К, величина которой однозначно характеризует глубину протекания процесса.
Зависимость восстановительного потенциала от концентрации ионов определяемая уравнением Нернста, а именно:
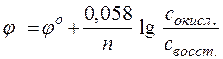
включает концентрацию тех ионов, которые написаны в уравнении электродной реакции, характеризуемой восстановительным потенциалом, после знака равенства (свосст) или перед знаком равенства (сокисл). Концентрации окисленных и восстановленных форм ставятся в степенях их стехиометрических коэффициентов. Так, для потенциала электродов в приведенном выше случае следует записать
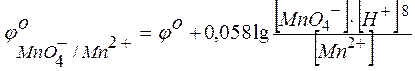 ;
;
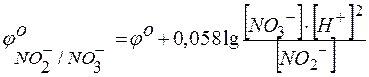 .
.
Окислительные свойства молекул или ионов тем сильнее, чем больше их потенциалы по алгебраической величине. Соотношения:
-nF 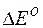 =
= 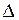 Go = – RT lnK =
Go = – RT lnK = 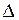 Ho – T
Ho – T 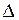 So
So
позволяют вычислить изменения свободной энергии 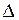 Go, энтальпии
Go, энтальпии 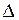 Ho, энтропии
Ho, энтропии 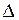 So и константу равновесия электрохимического процесса К по известным значениям Eo и T. Для этого достаточно знать равновесные ЭДС элементов хотя бы при двух температурах и решить систему из двух уравнений с двумя неизвестными.
So и константу равновесия электрохимического процесса К по известным значениям Eo и T. Для этого достаточно знать равновесные ЭДС элементов хотя бы при двух температурах и решить систему из двух уравнений с двумя неизвестными.
1.8.2. Электролиз
Электролизом называют окислительно-восстановительные реакции, протекающие на электродах при прохождении электрического тока через растворы или расплавы электролитов.
При электролизе электрод, соединенный с отрицательным полюсом внешнего источника постоянного тока, называется катодом (на нем идет восстановление), соединенный с положительным полюсом источника тока – анодом (на нем идет окисление).
В любом растворяемом в воде электролите под влиянием полярных молекул воды или под влиянием нагрева безводного электролита наблюдается процесс диссоциации его молекул на ионы. Поэтому при погружении в электролит электродов, соединенных с источником тока, происходит направленное перемещение ионов: катионов (положительно заряженных ионов) к катоду, анионов (отрицательно заряженных ионов) - к аноду. Например, при электролизе раствора или расплава хлорида натрия (NaCl) ионы Na+ перемещаются к катоду (К–), а ионы Cl- – к аноду(А+).
Различают растворимые и нерастворимые аноды. К первым относятся аноды, изготовленные из угля, графита или благородных металлов (золота, платины, палладия и т.п.). В этом случае к анодам перемещаются анионы кислотных остатков, и протекает соответствующий окислительный процесс. Например:
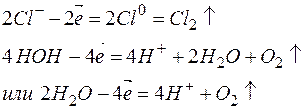
К растворимым анодам относятся аноды, изготовленные из любых металлов, кроме благородных. В этом случае происходит окисление (растворение) самого анода. Например, на медном аноде протекает следующий процесс:
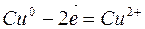
Для решения вопроса о составе полученных при электролизе продуктов необходимо учесть порядок восстановления катионов на катоде и анионов на аноде. Восстанавливающийся на катоде катион называется окислителем, окисляющийся анион – восстановителем.
Руководствуясь вторым началом термодинамики, таблицей стандартных электродных потенциалов металлов и ее свойствами, утверждающими, что окислительная способность катионов возрастает сверху вниз, а восстановительная способность атомов металлов – снизу вверх, в простейших случаях можно установить следующий порядок восстановления катионов на катоде.
В первую очередь восстанавливаются катионы металлов с наиболее положительными значениями стандартных электродных потенциалов (от золота до сурьмы включительно). Например:

Во вторую очередь преимущественно восстанавливаются катионы металлов, занимающих в ряду напряжений среднее положение (от вольфрама до марганца). Например:

Вместо всех остальных активных металлов, расположенных выше марганца, восстанавливаются молекулы воды с образованием на катоде газообразного водорода 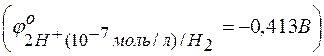 , что связано с большим перенапряжением восстановления указанных металлов:
, что связано с большим перенапряжением восстановления указанных металлов:
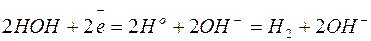
Пользуясь рядом стандартных окислительно-восстановительных потенциалов, можно приближённо установить порядок окисления анионов на аноде:
· В первую очередь окисляются анионы бескислородных кислот(S2-, I–, Br–, Cl–, CN–), за исключением иона фтора. Например:

· Во вторую очередь окисляются молекулы воды по уравнению: 
· В третью очередь окисляются анионы бескислородных кислот. Например: 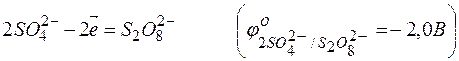
В случае растворимого анода происходит его окисление (см. выше). В случае протекания вышеперечисленных процессов по второму началу термодинамики система переходит в состояние с минимальным запасом энергии, т.е. её изобарно-изотермический потенциал  понижается
понижается 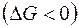 .
.
Рассмотрим примеры различных случаев электролиза.
Дата добавления: 2015-10-05; просмотров: 738;
