Секвенирование ДНК
Определение последовательности нуклеотидов в ДНК (секвенирование) является одной из важных, а часто и обязательных стадий изучения генома. Секвенированию подвергают очищенные (однородные) фрагменты однонитевой ДНК длиной 100—200 нуклеотидов. Получить такие фрагменты можно в ходе следующих операций: методом клонирования добиваются однородности рекомбинантных ДНК в составе одного клона; выделяют векторную ДНК из клеток; с помощью рестрикционных ферментов расщепляют клонированный сегмент ДНК на фрагменты указанной величины; при повышении температуры добиваются денатурации ДНК, получая однонитевые молекулы. Есть и более простой способ подготовки ДНК (пригоден для метода Сэнгера)— клонирование однонитевых фрагментов ДНК в составе векторов на основе фага М13.
Широко применяются два метода секвенирования: метод химического расщепленияМаксама и Гилберта и метод обрыва цепи Сэнгера. Наиболее современным и менее трудоемким считается метод обрыва цепи Сэнгера.
Секвенирование ДНК методом обрыва цепи. Этот метод основан на использовании специфических терминаторов синтеза ДНК — 2’,3’-дидезоксирибонуклеозидтрифосфатов. Эти молекулы нормально включаются в растущие цепи ДНК через свои 5’-трифосфатные группы, однако не образуют фосфодиэфирную связь со следующим дезоксирибонуклеозидтрифосфатом (dNTP). Когда в реакционную смесь для синтеза ДНК наряду с четырьмя нормальными dNTP вводят небольшое количество какого-либо дидезоксиNTP (например, ddATP), синтезируется набор цепей, специфически терминированных данным ddNTP. Если с одним и тем же фрагментом ДНК поставить четыре отдельные реакции, каждую с одним из ddNTP, то в каждой реакции образуется смесь вновь синтезированных молекул разной длины. При этом получается, что все синтезированные в такой системе цепи ДНК будут иметь одинаковый 5’-конец (он обусловлен использованием одной и той же затравки) и одинаковые нуклеотиды на 3’-конце. Теперь такие продукты можно разделить с помощью электрофореза в геле и определить по относительной длине образованных цепочек ДНК последовательность нуклеотидов в них (рис. 20.9).
Последовательность этапов в методе следующая: 1) получают однонитевые фрагменты ДНК, последовательность нуклеотидов в которых требуется определить (ДНК-матрицы); 2) синтезируют набор ddNTP; 3) синтезируют короткий фрагмент меченой ДНК, комплементарный 3’-концу матрицы (затравка); 4) готовят четыре реакционные смеси для синтеза ДНК, в состав каждой из которых входит какой-либо один ddNTP и соответствующий dNTP в строго определенном соотношении, а также три других dNTP; 5) в каждой из реакционных смесей дают осуществиться синтезу ДНК. Если соотношение ddNTP: dNTP выбрано правильно, образуется набор меченых молекул, длины которых равны расстояниям от остатков данного ddNTP до начала цепи; 6) денатурируют полученные смеси ДНК, добиваясь образования однонитевых молекул; 7) разделяют фрагменты по размеру методом электрофореза в геле (в пористом агарозном или полиакриламидном геле под действием электрического поля молекулы движутся со скоростью, обратно пропорциональной их величине); 8) проводят радиоавтографию и по картине распределения меченых фрагментов устанавливают нуклеотидную последовательность.
Наиболее современной модификацией метода Сэнгера является ис-
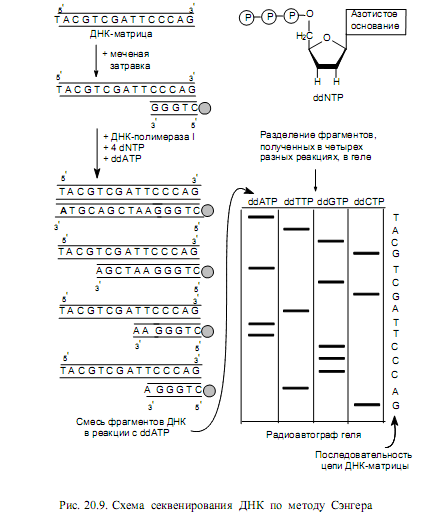
пользование клонированных в векторах на основе фага М13 однонитевых фрагментов ДНК. Место генома М13, в которое встраивается чужеродная ДНК, точно известно. Поэтому получены 8— 10-членные олигонуклеотиды, комплементарные участку ДНК М13, непосредственно прилегающему к клонированной последовательности. Эти нуклеотиды и служат затравками в полимеразных реакциях, т. е. появляется возможность использования одной и той же синтетической затравки для секвенирования любых вставок в данный вектор.
При оптимальных условиях с помощью данного метода можно в одном эксперименте определить строение фрагмента, включающего сотни нуклеотидов.
Секвенирование ДНК методом химического расщепления. Для фиксации начальной точки рестрикционных фрагментов ДНК осуществляют мечение их 5’-конца радиоактивным изотопом фосфора 32Р с помощью фермента полинуклеотидкиназы (рис. 20.10). Затем денатурируют ДНК, получая однонитевые цепи, и делят препарат на четыре порции. Каждую порцию обрабатывают реагентом, специфически разрушающим одно
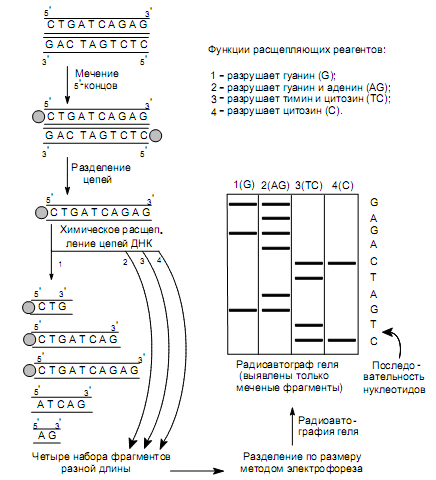
или два из четырех возможных азотистых оснований. Условия этой реакции подбирают таким образом, чтобы на каждую молекулу ДНК приходилось лишь несколько повреждений. После этого поврежденные молекулы обрабатывают пиперидином, который обусловливает разрывы цепей за нуклеотидом с поврежденным основанием. В результате получаются смеси, содержащие фрагменты разной длины, среди которых только меченые имеют «фиксированную» начальную точку (5ў-конец), и они смогут быть выявлены при радиоавтографическом анализе. Например, если во фрагменте длиной 10 нуклеотидов гуанилат находился в 3, 8 и 10 положениях, то при обработке реагентом, повреждающим гуанин, сформируются цепи из 3, 8, 10, 5 и 2 нуклеотидов. Из них только первые три, как содержащие радиоактивный изотоп фосфора, смогут образовать потемнение на рентгеновской пленке.
На заключительном этапе наборы меченых фрагментов, образующиеся при каждой из четырех реакций, подвергают электрофорезу в соседних дорожках полиакриламидного геля. Происходит разделение фрагментов ДНК в соответствии с их размерами. Осуществляют радиоавтографию геля и читают последовательность нуклеотидов в анализируемой цепи. При этом первый нуклеотид в цепи определяется самым коротким фрагментом ДНК, т. е. последним на радиоавтографе геля (рис. 20.10).
Дата добавления: 2015-09-29; просмотров: 1705;
