Минеральный состав питьевой воды
Вода пригодна для питья, если ее общая минерализация не превышает 1000 мг/л. Очень малая минерализация воды (до 100 мг/л) тоже ухудшает ее вкус, а вода, лишенная солей – дистиллированная, вредна для человеческого организма, так как ее употребление нарушает пищеварение идеятельность желез внутренней секреции. В соответствии с гигиеническими требованиями к качеству воды суммарная минерализация не должна превышать величины 1000 мг/л. По согласованию с органами санэпиднадзора для водопровода, подающего воду без соответствующей обработки (например, из артезианских скважин), допускается увеличение минерализации до 1500 мг/л.
Обычно говорят: чистая вода – залог здоровья. Вкусной воды в природе много, но идеально чистой нет и быть не может. Вода – один из лучших растворителей, поэтому капли дождя или снега до того как попасть на землю обогащаются азотом, кислородом, углекислотой, пылью и другими компонентами, находящимися в атмосфере. Так, в одном из самых чистых районов, в Енисейском секторе Арктики, вдали от Ледовитого океана в 1л воды, полученной из снега, содержится в среднем 93 мг минеральных солей, кислорода, натрия и серы. Даже дистиллированная вода аптек и лабораторий не является идеально чистой. Известный ученый Ф. Кольрауш 42 раза перегонял воду в специальном стеклянном сосуде при пониженном давлении, но идеально чистой воды так и не получил из-за проникновения из воздуха примесей углекислоты, кислорода и азота.
К настоящему времени установлено, что вода с повышением содержания хлоридов и сульфатов, помимо неприятного привкуса, приобретает и способность отрицательно влиять на функции системы пищеварения.Повышенное содержание кальция способствует камнеобразованию в почках и мочевом пузыре. Последние исследования показали, что длительное использование для питья вод хлоридно-сульфатного класса с минерализацией, повышенной до 3 г/л, весьма отрицательно влияет на течение беременности и родов, на плод и новорожденного, на гинекологическую заболеваемость.
Сравнительные данные о ПДК минеральных солей и некоторых металлов, действующих в разных странах, приведены в табл. 5.6.
Таблица 5.6 – ПДК некоторых химических веществ в питьевой воде, мг/л
| Показатель | Украина | Россия | Болгария | Чехия | ВОЗ |
| Сухой остаток | – | ||||
| Хлориды | |||||
| Сульфаты | |||||
| Железо | 0,3 | 0,3 | 0,2 | 0,3 | 1,0 |
| Марганец | 0,1 | 0,1 | 0,1 | 0,1 | 0,5 |
| Нитраты | |||||
| Цинк |
Содержание в питьевой воде большого количества растворимых кальциевых и магниевых солей не только отрицательно влияет на вкус, но и обусловливает ее жесткость. Жесткая вода неблагоприятна во многих отношениях: в ней труднее развариваются овощи и мясо, уменьшается их питательная ценность, резко ухудшается моющая способность и возрастает расход мыла. Жесткая вода образует накипь, которая портит чайники и котлы и засоряет водопроводные трубы. По последним научным данным, употребление жесткой воды способствует развитию ряда заболеваний. Так, при избыточном содержании в питьевой воде солей кальция и магния нарушается коллоидно-кристаллоидное равновесие мочи, что способствует возникновению мочекаменной болезни. В реальных жизненных условиях заболевание мочекаменной болезнью чаще всего, вероятно, вызывается не какой-либо одной причиной, а несколькими. Однако солевой состав питьевых вод – один из факторов, способствующих развитию этой болезни. Положительная рольжесткой питьевой воды – это меньше случаев инфаркта и приступов гипертонии.
Общая жидкость воды определяется суммой концентраций ионов кальция (кальциевая жидкость) и ионов магния (магниевая жесткость воды). Она складывается из карбонатной (временной, устраняется кипячением) и некарбонатной (постоянной) жесткости воды. Первая вызвана присутствием в воде гидрокарбонатов Са и Mg, вторая – наличием сульфатов, хлоридов, нитратов, фосфатов и силикатов этих металлов. При кипячении в течение 1 часа гидрокарбонаты Са и Mg разлагаются
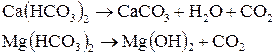
и жесткость воды при этом уменьшается. Поэтому иногда принимают термин «временная жесткость», понимая под этим присутствие гидрокарбонатов, удаляемых из воды при ее кипячении. Оставшаяся после кипячения жесткость воды называется постоянной жесткостью.
В Украине и России жесткость воды выражают в молях на 1м3. Числовое значение жесткости, выраженное в моль/м3, равно числовому значению жесткости, выраженному в мг-экв/л. Один моль на м3 соответствует массовой концентрации эквивалентов ионов кальция (1/2Са+2) 20,04 г/м3 и ионов магния (1/2 Mg+2) 12,15 г/м3. Общая жесткость Жоб складывается из кальциевой и магниевой жесткости, т.е. суммарной концентрации в виде ионов Са+2 и Mg+2:
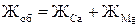 .
.
Если содержание катионов Са+2 и Mg+2 в воде было найдено другими методами, общую жесткость можно вычислить по формуле
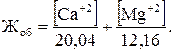 (5.1)
(5.1)
Жескость воды, умягченной для питания паровых котлов высокого давления, выражают в мкг-экв/л (1 мкг-экв = 0,001 мг-экв).
В других странах жесткость воды измеряют в градусах жесткости. Так, в Германии 10 жесткости выражает содержание 0,01г СаО в 1л воды; в Великобритании жесткость воды измеряют в градусах жесткости, выражающих содержание СаСО3 в гранах (1 гран=0,0648г) в 1галлоне (4,546л) воды; во Франции 10 жесткости равен 1г СаСО3 в 100000г воды. Сравнительные данные о единицах измерения жесткости воды в разных странах приведены в табл. 5.7.
Таблица 5.7 – Сравнительные данные о единицах жесткости воды
| Украина, мг-экв/л | Градусы жесткости | ||
| Германия | Великобритания | Франция | |
| 1,00 | 2,80 | 3,50 | 5,00 |
| 0,36 | 1,00 | 1,25 | 1,79 |
| 0,29 | 0,80 | 1,00 | 1,43 |
| 0,20 | 0,56 | 0,70 | 1,00 |
Величина общей жесткости в питьевой воде не должна превышать 7мг.экв/л; лишь в некоторых случаях по согласованию с Главным государственным санитарным врачом для конкретной системы водоснабжения допускается общая жесткость воды до 10 мг-.экв/л.
Жесткость воды колеблется в широких пределах. Вода с жесткостью менее 4мг-экв/л считается мягкой, от 4 до 8мг-экв/л – средней жесткости, от 8 до 12мг-экв/л – жесткой и выше 12мг-экв/л – очень жесткой. В поверхностных водоисточниках, где преобладает, как правило, карбонатная жесткость (до 70% от общей), а магниевая жесткость обычно не превышает 30% (реже 60% от общей: Донбасс, Кривой Рог), наибольшего значения жесткость воды достигает в конце зимы, наименьшего – в период паводка. В подземных водах жесткость воды более постоянна и меньше изменяется в течение года.
Жесткость морской воды: Черного моря – кальциевая 12мг-экв/л, магниевая 53,5мг-экв/л, общая 65,5мг-экв/л; океанов – кальциевая 22,5мг-экв/л, магниевая 108мг-экв/л, общая 130,5мг-экв/л.
В настоящее время на большом статистическом материале показано существование корреляционной связи между сердечно-сосудистыми заболеваниями и жесткостью питьевой воды: чем мягче питьевая вода, тем больше вероятность заболевания населения сердечно-сосудистыми заболеваниями. В частности, в США и Канаде установлено, что среди населения, потребляющего мягкую питьевую воду, содержащую менее 75 мг/л кальция, смертность на 15…20% выше, чем среди населения, потребляющего жесткую воду. Для Великобритании эта разница составляет 40%.
Следует отметить, что общепринятой точки зрения на механизм воздействия жесткости питьевой воды на деятельность сердечно-сосудистой системы нет: разные исследователи оценивают действия этого механизма неодинаково, расходятся они также во мнении о степени опасности мягкой питьевой воды для здоровья человека.
Существует несколько групп гипотез, объясняющих механизм действия качества питьевой воды на функции сердечно-сосудистой системы человеческого организма.
Согласно первой группе гипотез, жесткая вода обладает определенными защитными свойствами, связанными с наличием катионов магния и кальция в питьевой воде. По этой гипотезе, увеличение содержания кальция в воде препятствуетобразованию в организме холестерина, магний же препятствует накоплению в артериях липидов и обладает также антикоагуляционными свойствами, что способствует уменьшению вероятности тромбозов.
Так, при эпидемиологическом обследовании населения, употребляющего воду с низким содержанием магния (штат Огайо, США), обнаружены более высокая заболеваемость коронарной болезнью, а также случаи внезапной смерти по сравнению с районами, где население употребляет воду с нормальным содержанием данного микроэлемента. Содержание магния в миокарде людей, умерших от сердечных приступов, было пониженным на 12...15%.
Опубликованы данные, согласно которым при жесткости воды 7 мг-экв/л в организм поступает дополнительно 27% магния. В пользу роли «водного магния» свидетельствует лучшая усвояемость его из воды (до 60%) по сравнению с пищей пищи (30%). С учетом этого, данные о роли магния жестких вод в снижении сердечно-сосудистой патологии приобретают особое значение.
Вторая группа гипотез утверждает, что в жесткой воде содержится большее количество других элементов (помимо Mg и Ca), выполняющих защитные функции. В числе таких элементов, прежде всего, называются литий и ванадий, а также марганец и хром. Ванадий по некоторым данным, препятствует образованию холестерина, литий может способствовать улучшению кровообращения в венозных сосудах сердца.
Третья группа гипотез указывает на то, что мягкая вода из-за своих коррозионных свойств содержит большее количество металлов, отрицательно сказывающихся на работе сердечно-сосудистой системы. В числе таких металлов исследователи называют кадмий, свинец, медь и цинк. Кадмий и свинец, по-видимому, способствуют росту кровяного давления.
Дата добавления: 2015-09-23; просмотров: 4165;
