Железоуглеродистые сплавы.
Железо
В промышленности чистое железо практически не используется, а наиболее широко применяются его сплавы. Основными из них являются системы железа с углеродом называемые сталями и чугунами.
Диаграмма состояний сплавов в системе железо-углерод дает первостепенные представления и понятия о строении и свойствах их составляющих.
Однако прежде, чем начать рассмотрение самой диаграммы, следует ознакомиться со свойствами и структурой чистых компонентов системы и продуктами их различного взаимодействия.
Железо – химический элемент IV периода VIII группы периодической системы элементов Д. И. Менделеева. Химический знак Fe, атомный номер 26, радиус 0,127 нм, масса 55,85, металл.
Железо является одним из наиболее распространенных элементов в природе, уступая лишь кислороду, кремнию и алюминию. Общая его концентрация в земной коре в пересчете на свободный элемент составляет 5,1 %. В свободном виде оно находится в падающих на землю метеоритах. Распространены в природе различные соединения железа. Оно входит в состав большинства горных пород и минералов, из которых состоят месторождения железных руд. Основными из них являются следующие железняки: магнитный или магнетит - Fe3O4, красный или гематит - Fe2O3, бурый или гетит и лимонит - Fe2O3 и шпатовый или сидерит FeСO3. В природе в больших количествах часто встречается железный или серный колчедан (пирит) - FeS2, который служит сырьем для производства серной кислоты.
В зависимости от температуры окружающей среды железо может существовать в двух аллотропных или полиморфных модификациях (рис. 1.29.
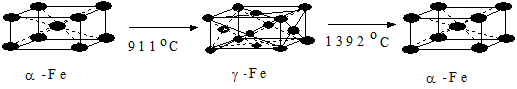
Рис. 1.29 - Полиморфные модификации железа и температуры их превращений
До 768 °С металл имеет объемно-центрированную кубическую решетку (К8) с периодом 0,286 нм и ферромагнитными свойствами, его обозначают a-Fe. При 768 °С оно переходит в b-Fe. У него исчезают ферромагнитные свойства, и железо становится парамагнитным, но кристаллическая структура его существенно не меняется. Критическую точку, соответствующую магнитному превращению, т. е. переходу из ферромагнитного состояния в парамагнитное называют точкой Кюри. При 911 °С происходит полиморфное превращение с трансформацией решетки в гранецентрированную кубическую (К12) с периодом d = 0,356 нм. Сам металл остается парамагнитным. Это g-Fe. При видоизменении наблюдается сжатие. Объемный эффект сжатия составляет примерно 1,0 %. В точке 1392 °С совершается новый аллотропный переход, при котором образуется d-Fe с объемно-центрированной кубической решеткой. Это строение железо сохраняет до температуры плавления. Данная модификация - парамагнитна.
Понятие бета-железа исчезло из научного словаря, когда было доказано, что фаза, для описания которой оно предназначалось, не отражает никакого кристаллографического перехода. Фазы альфа и дельта также кристаллографически идентичны и имеют разные обозначения потому, что считались в прошлом двумя разными формами.
Железо состоит из четырех стабильных изотопов с массовыми числами 54, 56, 57 и 58. Также применяются радиоактивные изотопы 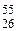 Fe и
Fe и 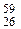 Fe.
Fe.
Железо - металл серебристо-белого цвета. На воздухе оно подвергается коррозии, покрываясь ржавчиной, представляющей собой смесь различных оксидов железа. Технически чистое железо содержит до 0,10 - 0,15 % примесей. Наиболее чистый металл состоит на 99,9917 % из железа. Свойства металла зависят от степени его чистоты. Температура плавления железа 1539 ± 5 °С, плотность –7,68 - 7,85 г/см3. Металл обладает невысокой твердостью и прочностью НВ » 80, sв » 25 кгс/мм2; s0,2 = 12 кгс/мм2 и хорошей пластичностью; d = 50 %; y = 80 %. Для поликристаллического железа, содержащего 99,8 - 99,9 % Fе, максимальная магнитная проницаемость mmax = (6,28 ¸ 12,5)·10-3 Г/м и коэрцитивная сила Нс= 39,8 ¸ 79,6 А/м; для чистого металла с 99,99 % Fе mmax = 35,2·10-3 Г/м и НC » 1,99 А/м. Коэффициент линейного расширения железа составляет 11,7×10-6 °C-1, удельное электросопротивление равно 10×104 Ом·м и теплопроводность 83,6 Вт/(м·К).
По своим химическим свойствам элемент является достаточно активным металлом. В образующихся химических соединениях он имеет степени окисления +2 и +3. При обычных температурах металл устойчив против воздействия сухого кислорода и воды, не содержащей данный газ. Железо при нагревании взаимодействует с такими неметаллами как кислород, галогены, сера, углерод и другие, образуя химические соединения по названию неметаллического элемента. Предварительно нагретый металл, внесенный в кислород, сгорает в нем, разбрасывая расплавленные капли окалины (искры) – Fe2O3. Разогретый порошок железа, помещенный в атмосферу хлора, горит с формированием его хлорида. При нагревании железо энергично реагирует с серой, образуя хрупкий сульфид. При очень высоких температурах оно взаимодействует с водой, вытесняя из нее водород. Поэтому во влажном воздухе и в воде, содержащей растворенный кислород, металл ржавеет. Разрушение железа, начавшееся на его поверхности, распространяется вглубь, так как корка из различных его оксидов получается рыхлой и не предохраняет металл от дальнейшего соприкосновения с агрессивной средой. В морской воде данный процесс протекает значительно интенсивнее, чем в обычной. Железо хорошо растворяется практически во всех минеральных кислотах различной концентрации с образованием разнообразных солей. Исключение составляют лишь сильно концентрированные серная и азотная кислоты, которые пассивируют его, что заключается в формировании на поверхности металла плотной тонкой корочки из его соединений, нерастворимых в данных кислотах. Это позволяет хранить и перевозить их в железной таре. Свойство железа вытеснять некоторые металлы из водных растворов их солей используют в металлургии для получения чистых металлов, например меди.
Расплавленное железо является хорошим растворителем многих металлов. Неограниченно растворяются в нем алюминий, медь, марганец, никель, кобальт, кремний, титан, цирконий и частично хром, ванадий, молибден, олово, платина, а также такие неметаллы, как углерод, сера, фосфор, мышьяк, селен, водород, азот и кислород. Не растворяются только свинец, серебро и висмут.
При затвердевании железа растворимость водорода, азота, кислорода и некоторых металлов резко падает и скачкообразно изменяется при переходе его из одной модификации в другую. В твердом металле неограниченно растворяются марганец, никель и кобальт. Предельная растворимость титана в железе составляет 60 %, ниобия 12 %, кремния около 19 %, вольфрама 33 %, молибдена 34 % и алюминия 35 %.
Железо значительно худший проводник электрического тока и тепла по сравнению с металлами подгруппы меди и алюминием. На основании этого его используют при разработке нагревостойких сплавов и систем с высоким сопротивлением. Последние употребляют при изготовлении изделий, предназначенных для работы только в постоянных магнитных полях. Технически чистое, электролитическое и карбонильное железо являются высокоиндукционными металлическими магнитомягкими материалами.
Технически чистое железо применяют как шихтовый материал для производства почти всех ферромагнитных сплавов.
Электролитическое железо получают в результате электролиза солей железа(II) сульфата FeSO4 или хлорида FeCl2. Осажденный на катоде металл имеет значительный недостаток. Он содержит большое количество водорода, поэтому не обладает высокими магнитными свойствами. Для улучшения данных параметров материал подвергают серии переплавок в вакууме и многократных отжигов. Таким способом добиваются значений коэрцитивной силы Нс и максимальной магнитной проницаемости mmах равными соответственно 30 А/м и 15000. Однако эти операции делают материал очень дорогим, поэтому его используют крайне редко. Из него изготавливают сердечники реле и электромагнитов, магнитных экранов, полюсов электрических машин и др.
Карбонильное железополучают в результате разложения его пентакарбонила Fe(CO)5. При различных условиях производят порошкообразный или губчатый металл. В результате термической обработки в водороде оно приобретает высокие магнитные свойства. Применяют карбонильное железо в качестве ферромагнитной фазы магнитодиэлектриков.
Как ферромагнитный материал железо является основным и наиболее дешевым компонентом в производстве магнитов. Металл применяют также в электровакуумных приборах как материал для анодов, экранов и других элементов, работающих при 500 °С.
Дата добавления: 2015-09-21; просмотров: 1337;
