Схема 43. Основные законы и принципы учения о химических процессах.
v Закон действующих масс. Скорость химических реакций при постоянной температуре пропорциональна произведению концентраций реагирующих веществ:
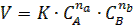
|
v Правило Вант-Гоффа. при повышении температуры на 10º скорость гомогенной реакции возрастает в γ раз:
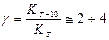
|
| v Принцип Ле-Шателье. Определяет подвижное равновесие. Химическим равновесием называется состояние, в котором скорость обратной реакции равна скорости прямой реакции. |
v Закон Аррениуса. Доля атомов (молекул), способных прореагировать: 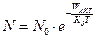
|
Особое значение в учении о химических процессах приобрел закон С. Аррениуса. Закон сохранения энергии не позволяет всем реагентам (молекулам) соединиться друг с другом; существует некоторый энергетический барьер (определяемый количеством связей, порядком расположения атомов), только преодолев который, вещества вступят в реакцию. С. Аррениус доказал, что в реакцию могут вступать только те молекулы (реагенты), которые обладают избыточной энергией, т.е. активные молекулы. При обычной температуре их доля увеличивается в соответствии с правилом Вант-Гоффа.
В XX веке особую роль приобрела физическая химия цепных химических реакций: большинство реакций идет не прямо, а через промежуточные продукты, потому что при этом значительно понижается энергия активации. Она уменьшается особенно заметно, если атомы или соединения, входящие в промежуточные реакции, имеют свободные, ненасыщенные валентности. Такие атомы и соединения называются радикалами. Их обычно обозначают точкой над химическим символом. Академик Н.Н.Семенов открыл в 1926-1932гг класс цепных реакций, где взамен одной свободной валентности (радикала) получается несколько свободных валентностей (радикалов). В 1956г за эти работы ему была присуждена Нобелевская премия по химии. Особую роль в учении о химических процессах приобрел катализ, который позволил перебросить мостик от классической к неклассической (квантовой) химии и эволюционной химии. Оказалось, что условия протекания химических процессов в современной химии становятся зависимыми не только от термодинамических (температуры, давления и т.п.), но и структурно-кинетических факторов: строения исходных реагентов; их концентрации; наличия в реакторе катализаторов (или ингибиторов) и других добавок; способов смешивания реагентов, материалов и конструкции реактора и т.п. Влияние такого типа факторов, воздействие которых зачастую носит неконтролируемый характер, может быть сведено к катализу.
В рамках концепции неконтролируемого воздействия в химии основные понятия катализа представим в табличном виде (см. схему 44). При этом химия все более учитывает вероятностный подход квантовой физики, а также законы и принципы как равновесной, так и неравновесной необратимой термодинамики.
Катализ определяет положительное воздействие на химический процесс, а ингибирование определяет сдерживающий процесс.
Схема 44. Основные понятия (определения) катализа.
| v Катализ - ускорение химической реакции в присутствии веществ – катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав конечного продукта. |
| v Гомогенный катализ - катализ, который происходит либо в газовой смеси, либо в растворе, в котором растворены как катализатор, так и реагенты. |
| v Гетерогенный катализ - катализ, при котором химическая реакция совершается в поверхностных слоях на границе раздела твердого тела, который обычно и выполняет роль катализатора, и газообразной или жидкой смеси реагентов. |
| v Ферментный катализ - катализ, в котором в качестве катализаторов используются ферменты, как природные, так и искусственные сложнейшие молекулярные системы - биологические катализаторы. |
| v Автокатализ - катализ, в котором в качестве катализатора выступают те или иные продукты химической реакции. |
Катализ играет решающую роль в процессе перехода от химических систем к биологическим.
Дата добавления: 2015-09-18; просмотров: 592;
