Ексцизійна репарація
Більш радикальним і ефективним шляхом виправлення порушень нуклеотидів є ексцизійна репарація (excision repair), коли пошкоджена одноланцюгова ділянка вирізається з ДНК, а інший ланцюг використовується далі як матриця для нового синтезу. Існує два варіантитакої репарації.
При ексцизійній репарації азотистих основ (Base Excision Repair –BER), що відбувається в усіх організмів, модифікована азотиста основа видаляється ферментом глікозилазою. Існує певна кількість специфічних глікозилаз, що розпізнають різноманітні модифіковані основи. Глікозилаза руйнує глікозидний зв’язок між основою та С1-атомом дезоксирибози (рис. 24). У ДНК залишається так званий АП-сайт (апуриновий / апіримідиновий), який упізнається ендонуклеазою, що гідролізує фосфодіефірний зв’язок між 5′-фосфатом звільненої від основи дезоксирибози та попереднім нуклеотидом. Нарешті фосфодіестераза відщеплює цю фосфодезоксирибозу, і в ДНК залишається прогалина довжиною в один нуклеотид. Ця прогалина заповнюється ДНК-полімеразою β (в еукаріотів), яка приєднує нуклеотид до 3′ ОН-групи попереднього нуклеотиду ланцюга. Фосфодіефірний зв’язок приєднаного нуклеотиду з наступним нуклеотидом ланцюга відновлюється лігазою.
У прокаріотів заповнення прогалини здійснюється ДНК-полімеразою І. При цьому, за рахунок своєї 5′-екзонуклеазної активності, полімераза може руйнувати певну ділянку з 5′-кінця прогалини, одночасно продовжуючи 3′-кінець.

Рис. 24. Ексцизійна репарація азотистих основ. Пошкоджена основа забарвлена червоним.
Ексцизійна репарація нуклеотидів (Nucleotide Excision Repair – NER) – процес, пов’язаний із вирізанням ділянки ДНК, яка містить пошкодження (модифіковану основу, тиміновий димер тощо).
У клітинах E. coli за цей шлях відповідає система uvrABC (uvr – ultraviolet repair). Комплекс білка uvrB і двох білків uvrA впізнає пошкодження та зв’язується з ДНК у цьому місці (рис. 25). На наступному кроці відбувається АТР-залежна зміна конформації uvrB, вигин ДНК і дисоціація uvrA. До комплексу рекрутується білок uvrС. Обидва білки у складі комплексу набувають ендонуклеазної активності: uvrС робить одноланцюговий розріз у пошкодженому ланцюзі за кілька нуклеотидів у напрямку до 5′-кінця від пошкодження (ліворуч на рис. 25); uvrB – розріз з іншого боку від пошкодження. Довжина ділянки між розрізами дорівнює 12 (або 13 у випадку для тимінового димеру) нуклеотидам. Далі геліказа uvrD руйнує подвійну спіраль між двома розрізами, тобто видаляє пошкоджену ділянку.
Прогалина, що залишилася, заповнюється ДНК-полімеразою І, лігаза остаточно відновлює цілісність ланцюга.
Аналогічна система ексцизійної репарації працює в еукаріотичних клітинах. До неї залучено близько 17 білків, причому за руйнування подвійної спіралі відповідає геліказна частина загального фактора транскрипції TFIIH. Це забезпечує тісну координацію репарації з транскрипцією: і підвищена ймовірність пошкоджень, і першочергова необхідність виправляти їх виникає насамперед у транскрипційно активних ділянках. Пошкодження розпізнаються або особливими білковими факторами, або РНК-полімеразою, яка робить зупинку на пошкодженому нуклеотиді. Після цього геліказа руйнує ділянку подвійної спіралі довжиною 24 – 32 пари основ, пошкоджена ділянка вирізається ендонуклеазами, і прогалина заповнюється ДНК-полімеразами δ/ε.
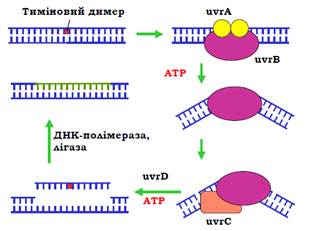
Рис. 25. Система uvrABC ексцизійної репарації нуклеотидів у E. Coli.
Дата добавления: 2015-09-11; просмотров: 3126;
