Багатоелектронні атоми.
Рівняння Шредінгера має точне розв’язання тільки для атома гідрогену.
Для багатоелектронних атомів використовують різноманітні методи наближень. Один з таких методів – метод Хартрі – Фока (метод самоузгодженого поля): обираються будь-які прийнятні значення хвильових функцій для кожного електрона в атомі, за виключенням одного, в розрахунку ефекту взаємодії ядра та всіх електронів, що залишились, з обраним електроном і в розрахунку так званої хвильової функції цього електрона. Потім обирають другий електрон (розрахунок проводять з урахуванням поліпшеної хвильової функції першого електрона) та розраховують поліпшену хвильову функцію для нього і далі до тих пір, поки не отримують поліпшені функції для усіх електронів в атомі. Потім весь цикл розрахунків повторюють, виходячи з поліпшених значень хвильових функцій, і отримують подальше поліпшення. Такі розрахунки повторюють доти, доки поліпшення не припиниться, тобто хвильові функції усіх електронів не стануть самоузгодженими.
У багатоелектронних атомах електрон взаємодіє не лише з ядром, а й з іншими електронами цього атома, відштовхуючись від них.
Багатоелектронні атоми можна уявити як системи, в яких у полі позитивно зарядженого ядра шарами розміщуються електрони, створюючи складні енергетичні рівні, побудовані з підрівнів. Стан електронів у багатоелектронних атомах відповідає принципу заборони Паулі:
в атомі не може бути двох електронів, у яких усі чотири квантові числа були б однакові.
Фізичний зміст цього принципу полягає в тому, що в одному й тому самому місці простору два електрони одночасно розміщуватися не можуть. Два електрони можуть займати одну орбіталь лише за умови, що вони мають протилежно спрямовані спіни. Кожна орбіталь незалежно від того, де вона розміщена, може мати максимум два електрони. Два електрони, які перебувають на одній орбіталі, наз. спареними.
Правило Хунда:
на підрівнях електрони розміщуються так, щоб сума їхніх спінових квантових чисел була максимальною.
Це пов’язане із взаємним відштовхуванням електронів, розміщених на підрівні. Електрони на вироджених орбіталях підрівня мають розміщуватись так, щоб взаємодіяти між собою з найменшою енергією, а це досягається за умови, що вони не спарюються. Утворення електронних пар енергетично невигідне і потребує затрат енергії, тому на схемі в усіх комірках підрівня, що заповнюється, спочатку розміщуються по одному електрону, а вже далі вони починають спарюватися.
Наприклад,
три електрони на 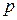 – підрівні:
– підрівні:
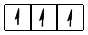
чотири електрони на 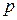 – підрівні:
– підрівні:
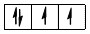
У багатоелектронних атомах електрони розміщуються в навколо ядерному просторі в послідовності поступового підвищення енергії. Енергія підрівнів зростає в міру збільшення головного квантового числа 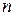 та орбітального квантового числа
та орбітального квантового числа 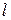 .
.
Дата добавления: 2015-09-02; просмотров: 879;
