КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ. ОСМОС
Для растворов характерен ряд свойств, обусловленных главным образом общим количеством частиц растворенного вещества в растворе. Такие свойства растворов называются коллигативными. Важным в биологическом плане свойством растворов является осмос.
В природе существуют полупроницаемые мембраны, разделяющие растворы различной концентрации. Мембраны имеют разный размер пор и способны пропускать через себя частицы (молекулы или ионы) соответствующего размера, то есть мембраны обладают избирательностью (селективностью). Большая часть биологических мембран пропускает через поры ионы неорганических веществ, низкомолекулярные частицы органических веществ, но при этом задерживают крупные молекулы высокомолекулярных веществ – белков, полисахаридов, нуклеиновых кислот, жиров.
Осмос – явление самопроизвольного перехода, то есть диффузии, молекул чистого растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией вещества.
С точки зрения термодинамики движущей силой осмоса является стремление системы к выравниванию свойств, в данном случае концентрации, по обе стороны мембраны. При этом энтропия системы возрастает, энергия Гиббса уменьшается, химические потенциалы выравниваются, поэтому осмос – самопроизвольный процесс.
Термодинамическое равновесие, наступающее в момент максимального значения осмотического давления называется осмотическим равновесием раствора.
Осмотическим давлением раствора называют величину, измеряемую минимальным гидростатическим давлением, которое нужно приложить к мембране со стороны раствора, чтобы осмос прекратился (т.е. наступило осмотическое равновесие).
Осмос не является свойством раствора или растворителя. Это явление, возникающее в системе при наличии градиента концентрации по обе стороны полупроницаемой мембраны.
Теоретическое выражение для расчета величины осмотического давлення введено в 1887г. Вант-Гоффом. Он предположил, что частицы вещества в растворе ведут себя аналогично молекулам газа и в таком же объеме системы, что позволило ему для оценки состояния системы использовать уравнение Менделеева-Клапейрона:
P V = 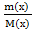 R Т
R Т
Заменив давление (Р) осмотическим давлением раствора π, получим уравнение:
π = 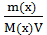 RT или
RT или
π = С(х) R T, где
π – осмотическое давление раствора, Па, кПа
m – масса растворенного вещества, г
M – молярная масса вещества, гˑмоль-1
V – объём, м3
R – универсальная газовая постоянная, R = 8,314 Дж ˑмол-1· К-1
Т – температура, К
Таким образом, осмотическое давление зависит от концентрации вещества в растворе, температуры и не зависит от природы вещества.
В растворах электролитов осмотическое давление выше, чем осмотическое давление неэлектролита той же концентрации. Это объясняется тем, что электролит диссоциирует на ионы, то есть общее число частиц в растворе увеличивается. Для учета диссоциации электролита Вант-Гофф ввел изотонический коэффициент.
Изотонический коэфициент (i) показывает отношение общего числа частиц (молекул и ионов) в растворе электролита к исходному числу молекул растворенного вещества.
i = 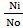 , где
, где
Ni – общее число частиц в растворе;
No – исходное число частиц.
Например: АlCl3 ↔ Al+3 + 3Cl-1
1 исх.част. 4 дочерние част.
i = 4 / 1 = 4
Для неэлектролитов Ni = N0, тогда i = 1.
Для электролитов Ni > N0, тогда i > 1.
Величина i зависит от степени диссоциации электролита (α) и числа дочерних частиц (υ):
i = 1 + α (υ – 1).
Для неэлектролитов α = 0, тогда i = 1.
Для сильных электролитов α → 1,
тогда i = 1 + (υ – 1) = υ.
Например:
NaCl ↔ Na+ + Cl-, α ≈ 1, υ = 2, тогда i = 2.
АlCl3 ↔ Al3+ + 3Cl-, α ≈1, υ = 4, тогда i = 4.
Таким образом, уравнение Вант-Гоффа для расчета величины осмотического давления раствора имеет общий вид:
π = 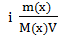 RT или π = i С(х) R T
RT или π = i С(х) R T
Явление осмоса имеет важное биологическое значение. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры, происходит усвоение питательных веществ, распределение их между органами и тканями, выведение продуктов жизнедеятельности. В организме человека величина осмотического давления биологических сред определяется, главным образом, разницей в концентрации ионов K+ и Na+ внутри клетки и межклеточной жидкости. При этом внутри клетки в 20-40 раз больше ионов K+, а в межклеточной жидкости, наоборот, концентрация ионов Na+ в 10-20 раз выше, чем во внутриклеточной жидкости. В итоге, внутри клетки ионов оказывается больше, поэтому вода избирательно всасывается клеткой и создает в ней давление от 4 до 20 атм, что определяет тургор клетки, то есть ее упругость и эластичность.
Осмотическое давление плазмы крови характеризуется достаточным постоянством – при 370C πкр = 740 -780 кПа (7,4 -7,7 атм).
При сравнении величины осмотического давления растворов, различают:
- изотонические растворы, имеющие одинаковую величину осмотического давления;
- гипертонические растворы – с большей величиной осмотического давления;
- гипотонические растворы – с меньшей величиной осмотического давления.
Изотоническими по отношению к плазме крови являются 0,85-0,89% растворы NaCl, а также 4,5 – 5,0% растворы глюкозы. Эти растворы используются внутривенно при больших кровопотерях, для поддержания давления крови и ритма сердечной мышцы.
Гипертонические растворы применяются для снятия отеков, дегидратации организма в том числе при аллергических реакциях (например, внутривенно применяют 10% раствор CaCl2). Для очистки гнойных ран используются гипертонические повязки.
Гипотонические растворы используются для поддержания тургора стенок кишечника (например, раствор Рингер-Локка), в составе глазных витаминных капель, а также в косметологии.
Контрольные вопросы
1. Осмос. Осмотическое давление растворов.
2. Уравнение Вант-Гоффа для электролитов и неэлектролитов.
3. Роль осмоса и осмотического давления в биологических системах. Изо-, гипер- и гипотонические растворы. Их применение в медицинской практике.
4. Гемолиз и плазмолиз.
5. Онкотическое давление крови.
Типовые задачи
Задача 1. Вычислить осмотическое давление раствора неэлектролита, в 2 дм3 которого содержится 0,25 моль вещества при 200С.
 Дано: Решение:
Дано: Решение:
n(Х)
Vр-ра = 2 дм3 = 2·10-3 м3 = C(x)·R·T или π = --------- RT
n = 0,25 моль V
T = 293К = (0,25 ׃ 2·10-3) · 8,314 · 293 = 3,045·105 Па =
R = 8,314 Дж·моль-1·К-1 = 304,5 кПа

- ? Ответ: = 3,045 · 105 Па.
Задача 2. При какой температуре (К) осмотическое давление раствора, содержащего 1,5 г хлорида калия в 1 дм3 раствора, составит 98450 Па?
| Дано: | Решение |
| m(KCl) = 1,5 г | 1. Для растворов электролитов m(X) π · М· V π = i ---------------RT => Т = -------------- M(X) · Vр i · m · R |
| Vр = 1 дм3 = 1·10-3 м3 | |
| π = 98450 Па | |
| Т = ? | |
| 2. Для электролита хлорида калия: KCl K+ + Cl- ( 1, = 2) i(KCl) = 1 + ·( -1) i(KCl) = 1 +1·(2 - 1) = 2 M(KCl) = 74,5 гмоль | |
| 3. Определяем температуру: 98450 · 74,5 · 1·10–3 Т = ----------------------------- = 294,06 К 2 · 1,5 · 8,314 | |
| Ответ: Т = 294,06 К |
Задача 3. Вычислить массу рибозы С5Н10О5, содержащуюся в 4 дм3 раствора при 270С, если осмотическое давление раствора рибозы составляет 84802,8 Па.
| Дано: | Решение: |
| Vр = 4 дм3 = 4·10-3 м3 | 1. Определим молярную массу рибозы: |
| Т = 27 0С = 300 К | M(С5Н10О5) = 12 · 5 + 1 · 10 + 16 · 5 = 150 гмоль |
| π = 84802,2 Па | 2. Определяем массу рибозы: m(X) π · М· V 84802,2 · 150 · 4·10-3 π = ---------------RT => m = -------------- = ---------------------------- = 20,4г M(X) · Vр R · T 8,314 · 300 |
| m(С5Н10О5) = ? | |
| Ответ: m(С5Н10О5) = 20,4 г. |
Задача 4. Сравните величины осмотических давлений растворов, содержащих в 1 дм3 соответственно 0,02 моль сахарозы (С12Н22О11), NaCl, MgCl2, FeCl3 при 270С.
 Дано: Решение:
Дано: Решение:
Vр-ров = 1 дм3 = 10-3 м3 = i·C(x)·R·T, т.е. при одинаковых величинах
n(x) = 0,02 моль С(x) и Т величины осмотических давлений растворов
Вещества: С12Н22О11, NaCl, зависят от величины изотонического коэффициента (i):
MgCl2, FeCl3 i = 1 +·( - 1)
 i (С12Н22О11) = 1, т.к. для неэлектролитов = 0,
i (С12Н22О11) = 1, т.к. для неэлектролитов = 0,
Сравнить р-ров - ? i(NaCl) = 2
i(MgCl2) = 3
i(FeCl3) = 4
Таким образом: ( С12Н22О11) = С(X)·R·T
( NaCl ) = 2·С(X)·R·T
( MgCl2) = 3·С(X)·R·T
(FeCl3) = 4·С(X)·R·T,
т.е. осмотическое давление будет больше в растворе FeCl3.
Ответ: будет больше в растворе FeCl3.
Дата добавления: 2015-11-20; просмотров: 2777;
