Основные физические свойства воды, снега и льда
Химические и физические свойства природных вод.
Основные физические свойства воды, снега и льда
Общие сведения. Вода имеет большое значение в жизни Земли. Являясь одним из распространенных и наиболее подвижных природных тел, она участвует почти во всех физических, климатических и биологических процессах, совершающихся на Земле.
При анализе гидрологических явлений принимается, что количество свободной воды на Земле сохраняется постоянным. Вода в результате некоторых процессов вступает в прочные соединения с другими веществами и перестает существовать как свободное образование, однако в глубоких слоях земной коры имеют место и обратные процессы: при высоких давлениях и температурах вновь образуется некоторое количество воды.
Жидкая вода в тонких слоях бесцветна, в толстых имеет голубовато-зеленый оттенок. Чистая вода, без примесей, почти не проводит электрический ток. Температура замерзания дистиллированной воды принята за 0° С, а температура кипения при нормальном давлении - за 100° С.
Природная вода никогда не бывает совершенно чистой. Наиболее химически чистой является дождевая вода, но и она содержит различные примеси, которые захватывает из воздуха. Попадая на землю, дождевая вода отчасти стекает по поверхности, отчасти просачивается в почво-грунты, образуя подземные воды. Стекая по поверхности земли и в толще почво-грунтов, вода растворяет различные вещества и превращается в раствор. Качественный и количественный характер изменений химического состава растворенных веществ и физических свойств воды весьма различен и зависит от всего комплекса физико-географических условий, в которых совершается процесс круговорота воды на Земле.
Строение воды. Вода состоит из 11,11% водорода и 88,89% кислорода (по весу). При образовании воды с одним атомом кислорода соединяются два атома водорода. В молекуле воды атомы водорода и кислорода расположены по углам равнобедренного треугольника: при вершине находится атом кислорода, а в углах при основании - по атому водорода (Рис.1).
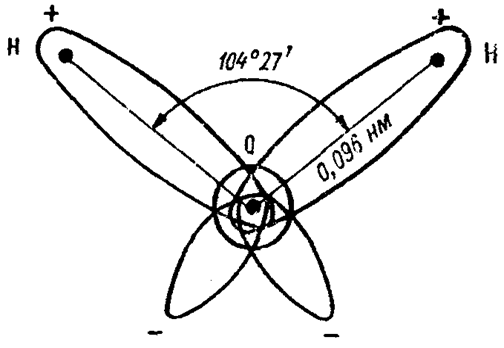
РИС. 1. СХЕМА СТРОЕНИЯ МОЛЕКУЛ ВОДЫ
Молекула воды характеризуется значительной полярностью вследствие того, что в ней оба атома водорода располагаются не на прямой, проведенной через центр атома кислорода, а как бы по одну сторону от атома кислорода. Это приводит к неравномерности распределения электрических зарядов. Сторона молекулы с атомом кислорода имеет некоторый избыток отрицательного заряда, а противоположная сторона, в которой размещены атомы водорода, - избыток положительного заряда электричества. Наличием полярности и некоторых других сил обусловлена способность молекул воды объединяться в агрегаты по несколько молекул.
Простейшую формулу H2O имеет молекула парообразной воды - гидроль.
Молекула воды в жидком состоянии представляет собой объединение двух простых молекул (Н2O)2 - дигидроль.
Молекула льда - объединение трех простых молекул (Н20)з - тригидроль.
В парообразном состоянии при температуре свыше 100° С, вода состоит главным образом из молекул гидроля, так как значительная скорость движения молекул при этой температуре нарушает ассоциацию (объединение) молекул.
В жидком состоянии вода представляет собой смесь гидроля, дигидроля и тригидроля, соотношение между которыми меняется с изменением температуры.
Во льду преобладают молекулы тригидроля, имеющие наибольший объем, а простые, необъединившиеся молекулы в нем отсутствуют.
Возможность перехода воды из одного агрегатного состояния в другое (из жидкого в лед или в пар и обратно) определяется температурой и давлением. Диаграмма состояния воды изображена на рис. 2.
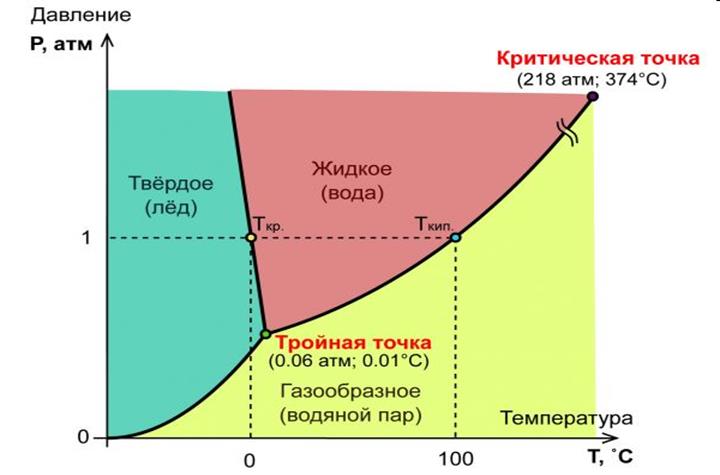
РИС. 2. ДИАГРАММА СОСТОЯНИЯ ВОДЫ
Линия АВ показывает границу равновесия между парообразной и твердой водой, линия ВС - между парообразной и жидкой водой. При температуре 0,0075°С и давлении 6,1 мб в устойчивом равновесии могут одновременно существовать лед, пар и жидкая вода (точка В на графике).
Если очень чистую воду охлаждать, тщательно предохраняя ее от сотрясения, то лед долго не образуется, несмотря на низкую температуру; практически такое охлаждение производилось до -72° С. Однако переохлажденная вода малоустойчива: при внесении в нес кристаллика льда или при встряхивании она сразу же превращается в лед. Переохлаждение воды в естественных водоемах на 0,005-0,01° С встречается весьма часто. В грунтах вследствие повышенной минерализации переохлаждение воды может быть более значительным.
Дата добавления: 2015-11-20; просмотров: 1306;
