Понятие о коррозии металлов. Виды коррозии: химическая и электрохимическая
Разрушение металла под воздействием окружающей среды называют коррозией.
Коррозия металлов может происходить в атмосфере, в агрессивных средах (растворах кислот, щелочей, солей), в сухих газах при высоких температурах. Продукты коррозии металлов можно наблюдать, например, в виде ржавчины на стали и чугуне, зелено
го налета на меди, белого налета на сплавах алюминия и т. д.
Коррозия помимо уничтожения металла отрицательно влияет на эксплуатационные характеристики деталей, содействуя всем видам разрушения.
Коррозия в зависимости от характера окружающей среды может быть химической и электрохимической.
Электрохимическая коррозия имеет место в водных растворах, а так же в обыкновенной атмосфере, где имеется влага.
Сущность этой коррозии в том, что ионы металла на поверхности детали, имея малую связь с глубинными ионами, легко отрываются от металла молекулами воды.
Металл, потеряв часть положительно заряженных частиц, ионов, заряжается отрицательно за счет избыточного количества оставшихся электронов. Одновременно слой воды, прилегающий к металлу, за счет ионов металла приобретает положительный заряд. Разность зарядов на границе металл – вода обуславливает скачок потенциала, который в процессе коррозии изменяется, увеличиваясь от растворения металла, и уменьшаясь от осаждения ионов из раствора на металле.
Если количество ионов переходящих в раствор и осаждающихся на металле одинаково, то скорости растворения и осаждения металла равны и процесс коррозии (разрушения металла) не происходит. Этому соответствует равновесный потенциал 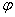 .
.
За нулевой потенциал принимают равновесный потенциал водородного иона в водном растворе. Стандартные потенциалы других элементов измерены по отношению к водородному потенциалу.
М  еталлы, стандартный потенциал которых отрицательный – корродируют в воде, в которой растворен кислород тем активнее, чем отрицательней значение электрохимического потенциала.
еталлы, стандартный потенциал которых отрицательный – корродируют в воде, в которой растворен кислород тем активнее, чем отрицательней значение электрохимического потенциала.
Уходящие ионы металла, взаимодействуя с ионами 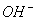 , образуют гидроксиды, нерастворимые в воде, которые называют ржавчиной, а процесс их образования – ржавлением.
, образуют гидроксиды, нерастворимые в воде, которые называют ржавчиной, а процесс их образования – ржавлением.
Схема ржавления железа:
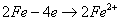 ;
;
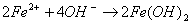
Гидроксид железа 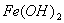 в присутствии кислорода, растворенного в воде, превращается в
в присутствии кислорода, растворенного в воде, превращается в 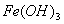 . Так как это нерастворимое соединение, то равновесный потенциал не может быть достигнут и коррозия будет продолжаться до полного разрушения.
. Так как это нерастворимое соединение, то равновесный потенциал не может быть достигнут и коррозия будет продолжаться до полного разрушения.
В зависимости от структуры коррозия имеет разное проявление: при однородном металле – коррозия происходит равномерно по всей поверхности. При неоднородном металле – коррозия избирательная и называется точечной. Это явление наиболее опасно, так как приводит к быстрой порче всего изделия. Избирательная коррозия создает очаги концентрации напряжений, что содействует разрушению.
Если два взаимно контактирующих металла с разными потенциалами погрузить в какой-либо электролит, то они образуют гальванический элемент. При образовании гальванической пары разрушаться будет тот металл, у которого потенциал относительно меньший. Например, в гальванической паре железо — цинк разрушаться будет цинк.
Неоднородность структуры сплавов и присутствие в них посторонних примесей, способствуя появлению на поверхности гальванических пар, ускоряют процесс коррозии. Простые металлы корродируют в меньшей степени, чем их сплавы. Чем чище металлы, тем выше их коррозийная стойкость.
Химическая коррозия может происходить за счет взаимодействия металла с газовой средой при отсутствии влаги. Продуктом коррозии являются оксиды металла. Образуется пленка на поверхности металла толщиной в 1…2 периода кристаллической решетки. Этот слой изолирует металл от кислорода и препятствует дальнейшему окислению, защищает от электрохимической коррозии в воде. При создании коррозионно-стойких сплавов – сплав должен иметь повышенное значение электрохимического потенциала и быть по возможности однофазным.
Статистикой подсчитано, что коррозия ежегодно уничтожает до 10% выплавляемого металла. От коррозии гибнет не только металл, она разрушает готовые изделия, стоимость которых на много выше стоимости самого металла. Такие огромные потери заставляют изыскивать надежные меры защиты металлов от коррозии и создавать коррозионностойкие материалы.
Металл или сплав считается коррозионностойким, если он хорошо сопротивляется воздействию внешней агрессивной среды. Один и тот же металл или сплав неодинаково сопротивляется коррозии в различных средах. Так, например, алюминий стоек в атмосфере и в пресной воде и нестоек в растворах щелочей, некоторых кислот и в морской воде.
Мерой коррозионной стойкости служит скорость распространения коррозии металлов в данной среде и в данных условиях: чем эта скорость меньше, тем металл более коррозионностоек.
В зависимости от коррозионной стойкости в той или иной среде металлические материалы разделяют на несколько групп:
а) коррозионностойкие (нержавеющие) материалы, стойкие против коррозии в атмосфере, в почве, в морской и пресной воде и в других средах;
6) жаростойкие (окалиностойкие) материалы, стойкие против коррозии в газовых средах при температурах выше 550° С и работающие в ненагруженном или слабо нагруженном состоянии;
в) жаропрочные материалы, работающие в нагруженном состоянии при высоких температурах в течение определенного времени и обладающие при этом достаточной жаростойкостью;
г) кислотостойкие материалы, стойкие против коррозии в агрессивных кислотных средах (в серной, соляной, азотной, фосфорной кислотах и их смесях разной концентрации).
Коррозионная стойкость может быть повышена, если содержание углерода свести до минимума, если ввести легирующий элемент, образующий с железом твердые растворы в таком количестве, при котором скачкообразно повысится электродный потенциал сплава.
Важнейшими коррозионно-стойкими техническими сплавами являются нержавеющие стали с повышенным содержанием хрома: хромистые и хромоникелевые.
Дата добавления: 2015-11-20; просмотров: 1825;
