Топливные элементы (ТЭ)
ТЭ относятся к числу химических источников электрической энергии. В качестве активный веществ, вступающих в химическую реакцию в ТЭ, используется твердое, жидкое или газообразное топливо (древесный уголь, нефтепродукты, спирты, водород и т.д.) схематическое устройство ТЭ рассмотрим на основе водородно-кислотного ТЭ.

Данный ТЭ состоит из положительного 1 и отрицательного 3 электродов, погруженных в щелочной электролит 2. Активным материалом положительного электрода является кислород O2, а отрицательного – водород Н2. Данные активные вещества хранятся отдельно от топливного элемента в особых хранилищах и поступают к электродам лишь во время отдачи им электрической энергии. Электроды ТЭ в реакциях активно не участвуют и в процессе работы не разрушаются, поэтому ТЭ обеспечивают непосредственное преобразование химической энергии в электрическую очень длительное время, пока идет активная подача веществ к его электродам. Расчеты показывают, что топливные элементы могут иметь очень высокие удельные характеристики, мощность и КПД.
Активные вещества подаются к электродам через пористые трубки. Водород вступает в соединение с ионами гидроксила электролита. В результате образуется вода и свободные электроны:
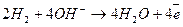 .
.
С водородного электрода свободные электроны перемещаются к кислородному электроду через нагрузку r. В пористом положительном электроде 1 кислород вступает в реакцию с водой электролита, образуя ионы гидроксильного остатка:
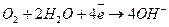 .
.
В результате в замкнутой цепи возникает электрический ток. Расход воды Н2О в элементы восполняет водород, а расход гидроксила ОН- восполняет кислород.
Рассмотренный химический процесс противоположен процессу электролитического разложения воды, где при пропускании тока через электролит вновь образуется кислород и водород. Этим объясняется высокий уровень КПД при выработке электрической энергии.
Аккумуляторы
Электрическим аккумулятором называют химический источник тока, который обладает способностью накапливать (аккумулировать) электрическую энергию и отдавать ее по мере надобности. При заряде аккумуляторы подключаются к постороннему источнику постоянного тока. Потребляемая им энергия преобразуется в химическую энергию, которая может длительно сохраняться и легко переходить в электрическую энергию при разряде аккумулятора. При этом израсходованные активные вещества аккумулятора легко восстанавливаются при последующем заряде.
Типы аккумуляторов
Свинцовые аккумуляторы (Pb). Реагентами в свинцовых аккумуляторах служат диоксид свинца (PbO2) и свинец (Pb), электролитом - раствор серной кислоты. Они также называются свинцово-кислотными аккумуляторами. Их разделяют на четыре основные группы; стартерные, стационарные, тяговые и портативные (герметизированные). Наиболее распространенные из свинцовых аккумуляторов - стартерные аккумуляторы, предназначены для запуска двигателей внутреннего сгорания и энергообеспечения устройств машин. В последние годы в основном используются аккумуляторы, не требующие ухода. К недостаткам относят невысокие удельную энергию и наработку, плохую сохранность заряда, выделение водорода.
Стационарные аккумуляторы используются в энергетике, на телефонных станциях, в телекоммуникационных системах, в качестве аварийного источника тока и т.д. Обычно они работают в режиме непрерывного подзаряда. Относятся к недорогим аккумуляторам.
Тяговые аккумуляторы предназначены для электроснабжения электрокаров, подъемников, шахтных электровозов, электромобилей и других машин. Действуют в режимах глубокого разряда, имеют большой ресурс и низкую стоимость.
Портативные (герметизированные) свинцовые аккумуляторы используются для питания приборов, инструмента, аварийного освещения. К их достоинствам относятся более низкая стоимость по сравнению со стоимостью других портативных аккумулторов, широкий интервал рабочих температур. Недостатками кислотных аккумуляторов являются невозможность хранения в разряженном состоянии, трудность изготовления аккумуляторов малых размеров.Никель-кадмиевые аккумуляторы (Ni-Cd). Реагентами в никель-кадмиевых аккумуляторах служат гидроксид никеля и кадмий, электролитом - раствор КОН, поэтому они именуются щелочными аккумуляторами. Существуют три основных вида никель-кадмиевых аккумуляторов: негерметичные с ламельными (ламельные аккумуляторы) и спеченными электродами (безламельные аккумуляторы) и герметичные. Наиболее дешевые ламельные никель-кадмиевые аккумуляторы характеризуются плоской разрядной кривой, высокими ресурсом и прочностью, но не низкой удельной энергией. Удельная энергия, скорость разряда Ni-Cd аккумуляторов со спеченными электродами выше, они работоспособны при низких температурах, но дороже, характеризуются эффектом памяти и способностью к тепловому разгону.
Применяются никель-кадмиевые аккумуляторы для питания шахтных электровозов, подъемников, стационарного оборудования, средств связи и электронных приборов, для запуска дизелей и авиационных двигателей и т.п.
Герметичные Ni-Cd аккумуляторы характеризуются горизонтальной разрядной кривой, высокими скоростями разряда и способностью действовать при низких температурах, но они дороже герметизированных свинцовых аккумуляторов и характеризуются эффектом памяти. Применялись для питания портативной аппаратуры (сотовых телефонов, магнитофонов, компьютеров и т.д.), бытовых приборов, игрушек и т.д. Недостатком никель-кадмиевых аккумуляторов является применение токсичного кадмия.
Никель-железные аккумуляторы. Вместо кадмия в этих аккумуляторах используется железо. Из-за выделения водорода с самого начала заряда аккумуляторы производят только в негерметичном варианте. Они дешевле никель-кадмиевых аккумуляторов, не содержат токсичный кадмий, имеют длинный срок службы и высокую механическую прочность. Однако они характеризуются высоким саморазрядом, низкой отдачей по энергии, практически неработоспособны при температуре ниже -10 °С. Выпускаются в призматическом виде и используются в основном как тяговые источники тока в шахтных электровозах, электрокарах и промышленных подъемниках.
Никель-металлогидридные аккумуляторы (Ni-MH). Активным материалом отрицательного электрода является интерметаллид, обратимо сорбирующий водород, т.е. фактически отрицательный электрод является водородным электродом, у которого восстановленная форма водорода находится в абсорбированном состоянии. Разрядная кривая Ni-MH аккумулятора аналогична кривой Ni-Cd аккумулятора. Удельная емкость и энергия никель-металлогидридных аккумуляторов в 1,5-2 раза выше удельной энергии никель-кадмиевых аккумуляторов, кроме того, они не содержат токсичный кадмий. Изготавливаются в герметичном исполнении цилиндрической, призматической и дисковой форм. Применяются для питания портативных приборов и аппаратуры.
Никель-цинковые аккумуляторы. Это щелочные аккумуляторы, у которых отрицательный электрод - цинковый. Удельная энергия никель-цинковых аккумуляторов примерно в 2 раза выше удельной энергии Ni-Cd аккумуляторов. Они характеризуются горизонтальной разрядной кривой, высокой удельной мощностью и относительно невысокой начальной ценой, однако ресурс их мал, поэтому массового применения не имеют. Применяются для питания портативной аппаратуры
Серебряно-цинковые и серебряно-кадмиевые аккумуляторы. Активными материалами служат оксид серебра на положительном и цинк или кадмий - на отрицательном электродах соответственно, электролитом является раствор щелочи. Характеризуются высокими удельными энергиями и мощностью, низким саморазрядом, но весьма дороги. Серебряно-цинковые аккумуляторы имеют незначительный ресурс. Выпускаются в призматической и дисковой формах, применяются для питания портативных приборов и аппаратов, в военной технике.
Никель-водородные аккумуляторы. Отрицательным электродом служит пористый газодиффузионный электрод с платиновым катализатором, на котором обратимо реагирует газообразный водород. Характеризуются высокой удельной энергией и очень высоким ресурсом, но значительным саморазрядом и очень дороги. Применялись в космической технике.
Литий-ионные аккумуляторы (Li-ion). В качестве отрицательного электрода применяется углеродистый материал, в который обратимо внедряются ионы лития. Активным материалом положительного электрода обычно служит оксид кобальта, в который также обратимо внедряются ионы лития. Электролитом является раствор соли лития в неводном апротонном растворителе. Аккумуляторы имеют высокую удельную энергию, высокий ресурс и способны работать при низких температурах. Благодаря высокой удельной энергии их производство в последние годы резко увеличилось. Выпускаются в цилиндрической и призматической формах. Они применяются в сотовых телефонах, ноутбуках и других портативных устройствах.
Литий-полимерные аккумуляторы (Li-pol). Анодом служит углеродистый материал, в который обратимо внедряются ионы лития. Активными материалами положительных электродов являются оксиды ванадия, кобальта или марганца. Электролитом является или раствор соли лития в неводных апротонных растворителях, заключенный в микропористую полимерную матрицу, или полимер (полиакрилонитрил, полиметилметакрилат, поливинилхлорид либо другие), пластифицированный раствором соли лития в апротонном растворителе (гель-полимерный электролит). По сравнению с литий-ионными аккумуляторами литий-полимерные аккумуляторы имеют более высокие удельную энергию и ресурс и лучшую безопасность. Применяются для питания портативных электронных устройств.
Перезаряжаемые марганцево-цинковые источники тока. Первичные цилиндрические марганцево-цинковые источники тока с щелочным электролитом определенного состава, изготовленные по специальной технологии, могут электрически перезаряжаться. Они характеризуются высокой удельной энергией, малым саморазрядом и невысокой стоимостью, выпускаются в герметичном исполнении, однако имеют очень малый ресурс (до 25-50 циклов), небольшую скорость разряда и наклонную разрядную кривую. Возможность перезаряда такого марганцево-цинкового источники тока отдельно оговаривается производителем.
Для питания устройств автоматики, телемеханики и связи (АТС) на ж.д. транспорте получили распространение свинцовые и щелочные (железно-никелевые, кадмиево-никелевые) аккумуляторы. В стационарных электропитающих установках используются свинцовые аккумуляторы, имеющие высокий КПД и незначительное снижения напряжения при разряде. Но они обладают высокой механической прочностью, поэтому чаще всего применяют в качестве временных источников энергии или в мобильных системах АТС.
1.4.2. Принцип действия свинцового аккумулятора
Простейший свинцовый аккумулятор имеет вид:
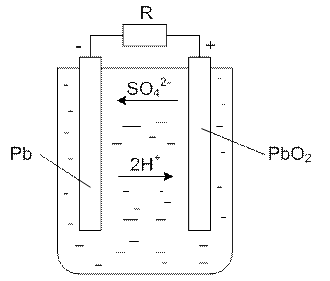
Как видно, аккумулятор состоит из двух свинцовый пластин, погруженных в водный раствор серной кислоты. Положительная пластина покрывается перекисью свинца PbO2 – вещество темно-коричневого цвета, а отрицательная пластина состоит из губчатого свинца Pb, который имеет светло-серый цвет. Перекись свинца и губчатый свинец являются активными веществами кислотного аккумулятора. Молекулы серной кислоты под действием растворителя распадаются на положительные ионы водорода и отрицательные ионы кислотного остатка SO4. Если к зажимам аккумулятора подсоединить нагрузку r, то аккумулятор начинает разряжаться. Положительные ионы водорода перемещаются к пластине с перекисью свинца и разряжаются на ней. Образующиеся при этом нейтральные молекулы водорода вступают в реакцию с активной массой перекиси свинца. Реакция на положительной пластине имеет вид:
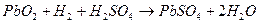 .
.
Отрицательные ионы кислотного остатка SO4 перемещаются к свинцовой пластине и, отдавая ей два электрона, вступают во взаимодействие с губчатым свинцом. Химическая реакция при этом имеет вид:
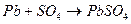 .
.
Таким образом, при разряде аккумулятора на положительной и отрицательной пластинах образуется серно-кислый свинец PbSO4. При образовании PbSO4 расходуется часть находящейся в электролите кислоты. Поэтому разряд аккумулятора сопровождается уменьшением плотности электролита. При глубоком разряде PbSO4 превращается в твердую крупно-кристаллическую соль, которая плохо восстанавливается в процессе заряда. Поэтому необходимо аккумуляторы разряжать до определенной плотности электролита. Для стационарных аккумуляторов плотность электролита при разряде должна составлять 1,17÷1,15 г/см3.
Заряд аккумуляторной батареи осуществляется постоянным током. При заряде аккумуляторной батареи постоянный ток от выпрямителя поступает на положительную пластину, и далее через электролит на отрицательную. На положительную пластину будут поступать отрицательные ионы SO2-, а к отрицательной пластине будут стремиться положительные ионы водорода 2Н+. После разряда ионы нейтрализуются и вступают в химическую реакцию с активной массой. Реакция на положительной пластине описывается уравнением:
PbSO4 + SO4 +2H2O → PbO2 + 2H2SO4;
реакция на отрицательной пластине описывается уравнением:
PbSO4 + H2 → Pb + H2SO4.
Масса положительной и отрицательной пластин восстанавливается, а плотность электролита увеличивается. Стационарные свинцовые аккумуляторы заряжаются до плотности 1,2 – 1,21 г/см3. После этого предела зарядный ток не восстанавливает активную массу на пластинах, а разлагает воду электролита на Н2 и О2, который образует взрывоопасную смесь – «гремучий газ».
Дата добавления: 2015-11-18; просмотров: 1029;
