Азотистая кислота HNO2.
Азотистая кислота в чистом виде не выделена и существует лишь в растворах, которые получают на холоде подкислением растворов ее солей:
Ba(NO2)2 + H2SO4 = 2HNO2 + BaSO4
Эти растворы имеют голубую окраску, они относительно устойчивы при 0 °С, а при нагревании до комнатной температуры разлагаются: 3HNO2= HNO3 + 2NO + H2O
Азотистая кислота легко диспропорционирует.
Окислительные свойства и прочность HNO3 и HNO2 удобно сопоставить с помощью диаграммы вольт-эквивалент — степень окисления. Легко заметить, что значение вольт-эквивалента HNO2 лежит выше прямой, соединяющей значения вольт-эквивалентов NO и HNO3. Следовательно,  G реакции диспропорционирования оказывается меньше нуля, иными словами, HNO2 является неустойчивой кислотой и стремится диспропорционировать на NO и HNO3. Кроме того, в разбавленных растворах одинаковой концентрации (0,1 М) HNO2 оказывается сильным окислителем, по силе превосходящим даже HNO3. Так, 0,05 М HNO2, мгновенно окисляет иодид калия:
G реакции диспропорционирования оказывается меньше нуля, иными словами, HNO2 является неустойчивой кислотой и стремится диспропорционировать на NO и HNO3. Кроме того, в разбавленных растворах одинаковой концентрации (0,1 М) HNO2 оказывается сильным окислителем, по силе превосходящим даже HNO3. Так, 0,05 М HNO2, мгновенно окисляет иодид калия:
2NaNO2 + 2H2SO4 + 2KI = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
а азотная кислота той же концентрации с KI не реагирует. Это следует и из диаграммы вольт-эквивалент—степень окисления. Действительно, наклон прямой, соединяющей значения вольт-эквивалентов HNO2 и NO, оказывается круче, чем в случае пары HNO3 и NO. Атом азота в HNO2 находится в промежуточной степени окисления, поэтому для азотистой кислоты и ее солей характерны не только окислительные, но и восстановительные свойства. Так, нитриты обесцвечивают подкисленный раствор перманганата калия: 5KNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
Нитриты щелочных, щелочноземельных металлов и аммония — бесцветные или желтоватые кристаллические вещества, хорошо растворимые в воде и плавящиеся без разложения. Нитриты переходных металлов в воде малорастворимы, а при нагревании легко разлагаются.
Отношение нитратов металлов к нагреванию.
Ме находящиеся левее Mg (кроме Li): МеNO2+O2
Ме находящиеся между [Mg и Cu] (и Li): MeO+NO2+O2
Ме находящиеся правее Cu: Ме+NO2+O2
Азотноватистая (гипоазотистая) кислота H2N2O2.Бесцветные кристаллы.Азотноватистая кислота — слабая и очень неустойчивая. Она и ее соли проявляют восстановительные свойства. При обезвоживании H2N2O2 концентрированной H2SO4 образуется оксид азота N2O, который формально можно рассматривать как ее ангидрид.
Нитроксиловая кислота H4N2O4. Всвободном виде она неустойчива.
2. Все щелочные металлы взаимодействуют с водой, выделяя водород:
2Ме+2H2O=2МеOH+H2
Эта экзотермическая реакция протекает очень быстро, натрий часто воспламеняется, а более тяжелые металлы реагируют со взрывом. Относительно низкая активность лития по отношению к воде определяется прежде всего кинетическими, а не термодинамическими причинами: литий наиболее твердый из щелочных металлов и имеет самую высокую температуру плавления, поэтому он медленнее дробится на капли и реагирует спокойнее других щелочных металлов.
Состав продуктов, образующихся при сгорании щелочных металлов на воздухе или в кислороде, зависит от природы металла. Так, литий образует оксид Li2O, натрий — пероксид Na2O2, калий, рубидий и цезий — супероксиды (надпероксиды) КO2, RbO2, CsO2. Все эти вещества имеют ионную кристаллическую решетку. Пероксиды: ст.окисл. -1, а супероксиды (надпероксиды) ст.окисл 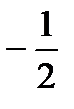 .
.
Взаимодействие с серой: При сплавлении натрия с серой образуются персульфиды типа Na2S2, Na2S3, Na2S4 и Na2S5.
Li не образует полисульфидов. Остальные образуют: K2S+nS=K2Sn
Э2S гидролизуются медленно, окисляются до тиосульфатов:
2Na2S+2O2+H2O=Na2S2O3+2NaOH
Взаимодействие с водородом:
Получают: Li(расплав)+H2=2LiH
NaH,KH,Cs,Rb разлагаются при нагревании. Все гидролизуются в воде: 2LiH+2H2O=2LiOH+H2
Взаимодействие с галогенами:
LiF- малорастворим. LiCl,LiBr,LiI-гигроскопичны, образуют кристаллогидраты.
NaГ, KГ, CsГ, RbГ- хорошо растворимые соли.
Прочность связи Li-Г в ряду F, Cl, Br, I уменьшается, причина- сильное поляризующее влияние иона лития.
Взаимодействие с азотом:
Li3N синтезируется при обычных условиях. Остальные нитриды получают действием тихого электрического разряда на пары щелочных металлов в атмосфере азота. Они не устойчивы. В воде гидролизуются: Li3N+3H2O=3LiOH+NH3
Оксиды, гидроксиды, соли.
Оксиды М2O их можно получить путем дозированного окисления металлов, однако в
этом случае конечный продукт будет содержать примеси. Цвет оксида изменяется
от белого (Li2O и Na2O) к желтому (K2O, Rb2O) и оранжевому (Cs2O). Удобным способом получения оксида натрия является взаимодействие натрия с расплавленным едким натром: 2NaOH + 2Na=2Na2O + H2
Для всех щелочных металлов получены озониды МO3, в состав которых входит парамагнитный ион [O3]-. Солеобразные КO3, RbO3, CsO3 получают действием озона на пероксиды, супероксиды или гидроксиды: КO2 + O3 = КO3 + O2
Все озониды представляют собой оранжево-красные кристаллические вещества. Они чрезвычайно взрывоопасны и неустойчивы.
Пероксиды, надпероксиды и озониды щелочных металлов при нагревании pазлагаются. Их термическая устойчивость увеличивается с ростом радиуса катиона. Пероксиды, надпероксиды и озониды являются сильными окислителями:
Na2O2 + CO = Na2CO3
Гидроксиды элементов первой группы являются сильными основаниями. Они представляют собой бесцветные гигроскопичные вещества, легко расплывающиеся на воздухе и постепенно превращающиеся в карбонаты. Гидроксиды щелочных металлов прекрасно растворимы в воде.
Гидроксиды натрия, калия, рубидия и цезия плавятся без разложения, в то время как LiOH при прокаливании выделяет воду: 2LiOH = Li2O + Н2O
Взаимодействие гидроксидов щелочных металлов с кислотами и кислотными оксидами приводит к образованию солей.
Нитраты щелочных Ме при нагревании разлагаются:
4LiNO3=2Li2O+4NO2+O2
Но остальные: 2NaNO3=2NaNO2+O2
Na2CO3*10H2O – кристаллическая сода
NaHCO3 – питьевая сода (Получение- аммиачный способ, метод Сольве:
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
2NaHCO3= Na2CO3+CO2+H2O (при нагревании)
Литий Li от остальных щелочных металлов отличает большее значение энергии ионизации и небольшой размер атома и иона. Литий по свойствам напоминает магний (диагональное сходство в периодической системе).
3. В окислительно-восстановительном процессе всегда участвуют две (сопряженные)
пары, каждая из которых включает окислитель и восстановитель. Процессу образования ионов способствует увеличение энтропии (энтропия ионов в растворе гораздо больше, чем энтропия металла) и образование гидратов, а препятствуют процессы ионизации (энергия ионизации достаточно высока) и разрушения кристаллической решетки. В состоянии равновесия на пластинке локализуется положительный заряд, который компенсируется противоионами, находящимися в растворе. Так возникает двойной электрический слой, характеризующийся некоторым скачком потенциала 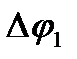 который зависит от природы металла, температуры и концентрации ионов металла в растворе. Величину
который зависит от природы металла, температуры и концентрации ионов металла в растворе. Величину 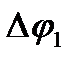 , нельзя ни измерить, ни рассчитать. Однако, если такой полуэлемент соединить проводником с другим полуэлементом (например,
, нельзя ни измерить, ни рассчитать. Однако, если такой полуэлемент соединить проводником с другим полуэлементом (например, 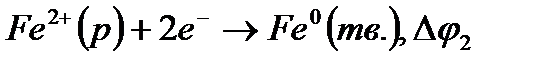 то между ними будет протекать электрический ток, обусловленный разностью потенциалов. Электродвижущая сила (Е) процесса, например реакции:
то между ними будет протекать электрический ток, обусловленный разностью потенциалов. Электродвижущая сила (Е) процесса, например реакции: 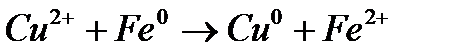
будет равна с высокой степенью приближения разности потенциалов полуэлементов:
Е = 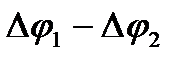 1.
1.
Вот эту величину — электродвижущую силу — измерить можно! Поэтому для характеристики полуэлементов (окислительно-восстановительных пар) используют величину ЭДС между данным полуэлементом и так называемым электродом сравнения. За электрод сравнения принят стандартный водородный электрод
2Н+(р)+2e-=H20
Условно принято считать, что 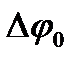 = 0 при давлении водорода, равном 1 атм,
= 0 при давлении водорода, равном 1 атм,
и активности Н+, равной 1. ЭДС цепи, составленной из стандартного водородного электрода и изучаемого электрода, называют электродным потенциалом последнего. Если активности (концентрации) ионов равны единице, то этот потенциал называют
стандартным (Е°). Так, для окислительно-восстановительной пары Cu2+/Cu°, при
[Си2+] = 1 моль/л: Е = 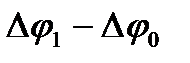 = Е° (Cu2+/Cu°).
= Е° (Cu2+/Cu°).
Уравнение 1. для окислительно-восстановительного процесса в целом можно записать так: 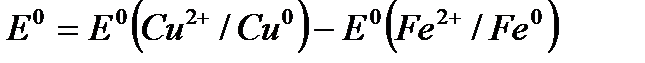
или в более общем виде: E=Eок-Евос
где Еок — электродный потенциал пары, выступающей в качестве окислителя; Евос — электродный потенциал пары, выступающей как восстановитель.
Билет №9
Реакционная способность Р оказывается более высокой, чем азота. С металлами Р взаимодействуют с образованием фосфидов. Их получают нагреванием смеси пниктогена с металлом в инертной атмосфере или в запаянной ампуле.
Гидролиз фосфида: Mg3P2+6H2O=2PH3+3Mg(OH)2
Mg3P2+6HCl=2PH3+3MgCl2
Фосфор диспропорционирует
Р4 + 6Н2O = РН3 + ЗН3PO2
В кислой и нейтральной средах равновесие сильно смещено влево, и реакция практически не протекает. Равновесие смещается вправо под действием
щелочей: Р4 + ЗКОН + ЗH2O=PH3 + ЗКН2PO2
Фосфин образует с воздухом взрывчатые смеси, а при поджигании сгорает, превращаясь в метафосфорную кислоту: РН3 + 2O2=НРО3 + Н2O
Фосфин плохо растворим в воде. Реагирует только с очень сильными кислотами (HI, HClO4)
Алотропия фосфора.
Белый фосфор. Мягкое кристаллическое вещество с неприятным чесночным запахом, практически не растворим в воде, мало растворим в бензоле, хорошо растворим в сероуглероде. Он сильно ядовит, на воздухе горит. Имеет молекулярную решетку в узлах которой находятся тетраэдрические молекулы
P4. Высокая реакционная способность.
Красный фосфор.P∞ Образуется при нагревании белого до 320 градусов без доступа воздуха.Он не растворим в сероуглероде, но растворяется в расплавленном висмуте и свинце.
Черный фосфор. При нагревании 200 оС и давлении 1200 атм. Красный переходит в черный фосфор- термодинамически более выгодную форму. Напоминает графит.
Оксиды.
Оксиды Э2O3 получают при взаимодействии простых веществ с кислородом. Оксид фосфора(III) представляет собой белый рыхлый кристаллический порошок, легко возгоняющийся. Оксид фосфора(III) называют фосфористым ангидридом, так как он взаимодействует с холодной водой с образованием фосфористой кислоты:
Р4O6+6Н2O = 4Н3PO3
Оксиды фосфора(III) проявляют кислотные свойства
Оксиды Э2O5 (Э4О10).Оксид фосфора(V) (или фосфорный ангидрид) представляет
собой рыхлый белый порошок. Оксид фосфора(V) чрезвычайно жадно присоединяет воду. Реакция сопровождается сильным разогреванием и приводит к образованию
сложной смеси, состоящей из метафосфорных кислот разного состава, которые при кипячении гидролизуются до ортофосфорной кислоты Н3PO4.
Дата добавления: 2015-08-11; просмотров: 6841;
