Основания
Основаниями с позиций теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид - ионов OH ‾ и ионов металлов (исключение NH4OH).
Основания классифицируют по их силе (по способности к электролитической диссоциации – на сильные и слабые), по кислотности (по количеству гидроксогрупп в молекуле, способных замещаться на кислотные остатки – на однокислотные, двукислотные и т. д.), по растворимости (на растворимые основания – щелочи и нерастворимые). Например: NaOH – сильное, однокислотное основание, растворимое (щелочь); Cu(OH)2 – слабое, двукислотное, нерастворимое основание. К растворимым основаниям (щелочам) относятся гидроксиды щелочных и щелочноземельных металлов. К сильным основаниям относятся все щелочи.
Химические свойства оснований:
1. Взаимодействие с кислотами:
Ca(OH)2 + H2SO4 = CaSO4 ¯ + H2O.
2. Взаимодействие с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3 + H2O.
3. Взаимодействие с амфотерными оксидами:
2KOH + Al2O3 = 2KAlO2 + H2O 1,
2KOH + SnO + H2O = K2[ Sn(OH)4 ].
4. Взаимодействие с амфотерными основаниями:
2NaOH + Zn(OH)2 = Na2ZnO2 +2H2O2,
2NaOH + Zn(OH)2 = Na2[ Zn(OH)4 ]3.
5. Термическое разложение оснований с образованием оксидов и воды:
Ca(OH)2  =
=  CaO + H2O.
CaO + H2O.
Гидроксиды щелочных металлов при нагревании не распадаются.
6. Взаимодействие с амфотерными металлами (Zn, Al, Pb, Sn, Be):
Zn + 2NaOH + 2H2O = Na2 [Zn(OH)4] + H2↑
Амфотерные гидроксиды. Амфотерные гидроксиды ( гидраты амфотерных оксидов ) способны диссоциировать в водных растворах как по типу кислот, так и по типу оснований. Например:
ZnO22- + 2H+ Û Zn(OH)2 Û Zn2+ + 2OH 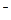 .
.
Поэтому они обладают амфотерными свойствами, т.е. могут взаимодействовать как с кислотами, так и с основаниями:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Sn(OH)2 + 2NaOH = Na2[ Sn(OH)4 ].
Номенклатура оснований.Названия оснований строятся из слова “гидроксид” и названия металла в родительном падеже с указанием в скобках римскими цифрами его степени окисления, если это величина переменная. Иногда к слову гидроксид добавляют префикс из греческого числительного, указывающий на число гидроксогрупп в молекуле основания. Например: KOH - гидроксид калия; Al(OH)3 - гидроксид алюминия (тригидроксид алюминия); Cr(OH)2 – гидроксид хрома (II) (дигидроксид хрома).
Соли
С точки зрения теории электролитической диссоциации соли - это вещества, диссоциирующие в растворах или в расплавах с образованием положительно заряженных ионов, отличных от ионов водорода, и отрицательно заряженных ионов, отличных от гидроксид – ионов.
Соли рассматривают обычно как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками. При полном замещении получаются средние (или нормальные) соли, диссоциирующие в растворах или в расплавах с образованием катионов металлов и анионов кислотных остатков (исключение – соли аммония). При неполном замещении водорода кислоты получаются кислые соли, при неполном замещении гидроксогрупп основания – основные соли. Диссоциация кислых и основных солей рассматривается в разделе 8. Кислые соли могут быть образованы только многоосновными кислотами (H2SO4, H2SO3, H2S,H3PO4 и т. д.), а основные соли – многокислотными основаниями (Mg (OH)2,Ca (OH)2, Al (OH)3 и т. д.).
Примеры образования солей:
Ca (OH)2 + H2SO4 = CaSO4 + 2H2O,
CaSO4 (сульфат кальция) – нормальная (средняя) соль;
H2SO4 + NaOH = NaHSO4 + H2O,
NaHSO4 (гидросульфат натрия) – кислая соль, полученная в результате недостатка взятого основания;
Cu (OH)2 + HCl = CuOHCl + H2O,
CuOHCl (хлорид гидроксомеди (II)) – основная соль, полученная в результате недостатка взятой кислоты.
Химические свойства солей:
I. Соли вступают в реакции ионного обмена, если при этом образуется осадок, слабый электролит или выделяется газ:
с щелочами реагируют соли, катионам металлов которых соответствуют нерастворимые основания:
CuSO4 + 2NaOH = Na2SO4 + Cu (OH)2↓;
с кислотами взаимодействуют соли:
а) катионы которых образуют с анионом новой кислоты нерастворимую соль:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl;
б) анионы которой отвечают неустойчивой угольной или какой-либо летучей кислоте (в последнем случае реакция проводится между твердой солью и концентрированной кислотой):
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑,
NaClтв + H2SO4конц = NaHSO4 + HCl↑;
в) анионы которой отвечают малорастворимой кислоте:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl;
г) анионы которой отвечают слабой кислоте:
2CH3COONa + H2SO4 = Na2SO4 + 2CH3COOH;
cоли взаимодействуют между собой, если одна из образующихся новых солей нерастворима или разлагается (полностью гидролизуется) с выделением газа или осадка:
AgNO3 + NaCl = NaNO3+ AgCl↓,
2AlCl3 + 3Na2CO3 + 3H2O = 2Al (OH)3↓ + 6NaCl + 3CO2.
II. Соли могут вступать во взаимодействие с металлами, если металл, которому соответствует катион соли, находится в“Ряду напряжений “правее реагирующего свободного металла (более активный металл вытесняет менее активный металл из раствора его соли):
Zn + CuSO4 = ZnSO4 + Cu.
III. Некоторые соли разлагаются при нагревании:
CaCO3 = CaO + CO2.
IV. Некоторые соли способны реагировать с водой и образовывать кристаллогидраты:
CuSO4 + 5H2O = CuSO4٭ 5H2O ΔH<0
белого цвета сине-голубого цвета
Выделение теплоты и изменение цвета – признаки химических реакций.
V. Соли подвергаются гидролизу. Подробно этот процесс будет описан в разделе 8.10.
VI. Химические свойства кислых и основных солей отличаются от свойств средних солей тем, что кислые соли вступают также во все реакции, характерные для кислот, а основные соли вступают во все реакции, характерные для оснований. Например:
NaHSO4 + NaOH= Na2SO4 + H2O,
MgOHCl + HCl = MgCl2 + H2O.
Получение солей:
1. Взаимодействие основного оксида с кислотой :
CuO + H2SO4 = CuSO4 + H2O.
2. Взаимодействие металла с солью другого металла:
Mg + ZnCl2 = MgCl2 + Zn.
3. Взаимодействие металла с кислотой:
Mg + 2HCl = MgCl2 + H2.
4. Взаимодействие основания с кислотным оксидом:
Ca(OH)2 + CO2 = CaCO3 + H2O.
5. Взаимодействие основания с кислотой:
Fe(OH)3 + 3HCl= FeCl3 + 3H2O.
6. Взаимодействие соли с основанием:
FeCl2 + 2KOH = Fe(OH)2 ¯ + 2KCl.
7. Взаимодействие двух солей:
Ba(NO3)2 + K2SO4 = BaSO4 ¯ + 2KNO3.
8. Взаимодействие металла с неметаллом:
2K + S = K2S.
9. Взаимодействие кислоты с солью:
CaCO3 + 2HCl = CaCl2 + H2O + CO2.
10. Взаимодействие кислотного и основного оксидов:
CaO + CO2 = CaCO3.
Номенклатура солей.Согласно международным номенклатурным правилам, названия средних солей образуются из названия кислотного остатка в именительном падеже и названия металла в родительном падеже с указанием в скобках римскими цифрами его степени окисления (если это величина переменная). Название кислотного остатка состоит из корня латинского наименования кислотообразующего элемента, соответствующего окончанияи в некоторых случаях приставки.
Кислотные остатки бескислородных кислот получают окончание ид. Например: SnS – сульфид олова (II), Na2Se – селенид натрия. Окончания названий кислотных остатков кислородсодержащих кислот зависят от степени окисления кислотообразующего элемента. Для высшей его степени окисления (“-ная “ или “-овая “ кислота) применяется окончание -ат. Например, соли азотной кислоты HNO3 называются нитратами, серной кислоты H2SO4 - сульфатами, хромовой кислоты H2CrO4 – хроматами. Для более низкой степени окисления кислотообразующего элемента (“...истая кислота “) применяется окончание ит. Так, соли азотистой кислоты HNO2 называются нитритами, сернистой кислоты H2SO3 – сульфитами. Если существует кислота с еще более низкой степенью окисления кислотообразующего элемента (“-оватистая кислота “ ), ее анион получает приставку гипо- и окончание -ит. Например, соли хлорноватистой кислоты HClО называют гипохлоритами.
Соли некоторых кислот в соответствии с исторически сложившейся традицией сохранили названия, отличающиеся от систематических. Так, соли марганцовой кислоты HMnO4 называют перманганатами, хлорной кислоты HClO4 – перхлоратами, йодной кислоты HIO4 – периодатами. Соли марганцовистой кислоты H2MnO4, хлорноватой HClO3 и йодноватой HIO3 кислот называют соответственно манганатами, хлоратами и йодатами.
Названия кислых и основных солей образуются по тем же общим правилам, что и названия средних солей. При этом название аниона кислой соли снабжают приставкой гидро-, указывающей на наличие незамещенных атомов водорода; количество незамещенных атомов водорода указывают греческими числительными приставками. Например, Na2HPO4 – гидроортофосфат натрия, NaH2PO4 – дигидроортофосфат натрия.
Аналогично катион основной соли получает приставку гидроксо-, указывающую на наличие незамещенных гидроксогрупп. Число гидроксильных групп указывают греческим числительным. Например, Cr(OH)2NO3 – нитрат дигидроксохрома (III).
Названия важнейших кислот и их кислотных остатков приведены табл. 4.1.
Таблица 4.1
Названия и формулы кислот и их кислотных остатков
| Название кислоты | Формула кислоты | Кислотный остаток | Название кислотного остатка |
| Азотная | HNO3 | NO3 ‾ | нитрат |
| Азотистая | HNO2 | NO2 ‾ | нитрит |
| Бромоводородная | HBr | Br ‾ | бромид |
| Йодоводородная | HI | I ‾ | йодид |
| Кремниевая | H2SiO3 | SiO32¯ | силикат |
| Марганцовая | HMnO4 | MnO4¯ | перманганат |
| Марганцовистая | H2MnO4 | MnO42¯ | манганат |
| Метафосфорная | HPO3 | PO3¯ | метафосфат |
| Мышьяковая | H3AsO4 | AsO43¯ | арсенат |
Продолжение табл. 4.1
| Мышьяковистая | H3AsO3 | AsO33¯ | арсенит |
| Ортофосфорная | H3PO4 | PO43¯ | ортофосфат (фосфат) |
| Пирофосфорная | H4P2O7 | P2O74¯ | пирофосфат (дифосфат) |
| Двухромовая | H2Cr2O7 | Cr2O72¯ | дихромат |
| Родановодородная | HCNS | CNS¯ | роданид |
| Серная | H2SO4 | SO42¯ | сульфат |
| Сернистая | H2SO3 | SO32¯ | сульфит |
| Фосфористая | H3PO3 | PO33¯ | фосфит |
| Фтороводородная (плавиковая) | HF | F¯ | фторид |
| Хлороводородная (соляная) | HCl | Cl¯ | хлорид |
| Хлорная | HClO4 | ClO4¯ | перхлорат |
| Хлорноватая | HClO3 | ClO3¯ | хлорат |
| Хлористая | HClO2 | ClO2¯ | хлорит |
| Хлорноватистая | HClO | ClO¯ | гипохлорит |
| Хромовая | H2CrO4 | CrO42¯ | хромат |
| Циановодородная (синильная) | HCN | CN¯ | цианид |
Дата добавления: 2015-08-08; просмотров: 967;
