Теория метода валентных связей
Метод разработан В. Гейтлером и Дж. Лондоном. Большой вклад в его развитие внесли также Дж. Слейтер и Л. Полинг.
Основные положения метода валентных связей:
1. Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных облаков и между атомами возникает зона с повышенной электронной плотностью. Это приводит к уменьшению потенциальной энергии системы.
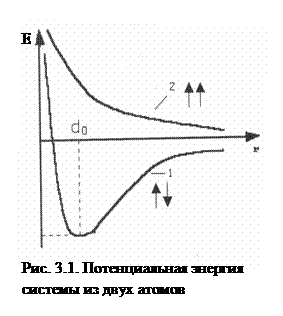 Основатели метода валентных связей Гейтлер и Лондон (1927г.) рассчитали потенциальную энергию системы, состоящей из двух атомов водорода (два протона и два электрона). Для расчета энергетического состояния электронов в молекуле водорода было использовано уравнение Шредингера для двух вариантов: а) спины электронов сближающихся атомов антипараллельны, ↑↓; б) спины электронов сближающихся атомов параллельны, ↑↑ (рис. 3.1).
Основатели метода валентных связей Гейтлер и Лондон (1927г.) рассчитали потенциальную энергию системы, состоящей из двух атомов водорода (два протона и два электрона). Для расчета энергетического состояния электронов в молекуле водорода было использовано уравнение Шредингера для двух вариантов: а) спины электронов сближающихся атомов антипараллельны, ↑↓; б) спины электронов сближающихся атомов параллельны, ↑↑ (рис. 3.1).
Проведенный расчет показал, что:
а) при сближении двух атомов водорода с антипараллельными спинами (кривая 1) на расстояние d0 система имеет минимальную энергию; cледовательно, в этом случае образуется устойчивая химическая связь с энергией Есв. и длиной связи ℓ: ℓ = 0,074 нм < 2а0 = 0,106 нм (а0 – радиус атома водорода);
б) если спины электронов паралельны (↑↑), энергия системы при любом расстоянии между сближающимися атомами больше, чем сумма энергий двух отдельных атомов (кривая 2) и образование химической связи невозможно.
2. В пространстве связь располагается по направлению, в котором возможность перекрывания электронных облаков наибольшая. Из нескольких связей, образуемых данным атомом, наиболее прочной будет та связь, у которой перекрывание атомных орбиталей наибольшее.
3. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность.
Дата добавления: 2015-08-08; просмотров: 653;
