Каспазы
По определению апоптоз — каспаза-зависимый процесс. Англоязычное слово CASPASE — аббревиатура CysteineAspartate Specific proteASE. Программированная клеточная гибель предполагает активацию каспаз и обусловленную ими деградацию белка в клетке. Каспазы принадлежат семейству ICE-подобных (ICE —Interleukin-1-Converting Enzyme) цистеиновых аспартат-специфичных протеаз, присутствующих в клетке в виде неактивных предшественников. Каспазы расщепляют белок за остатком аминокислоты аспартата (Asp). Этот сайт расщепления уникален для каспаз и протеазы гранзим В. В своих активных центрах каспазы содержат остатки аминокислоты цистеина. Идентифицировано не менее 14 изоформ каспазы, которые подразделяют на ингибиторные, эффекторные и воспалительные. Инициаторные (запускающие апоптоз) каспазы, такие как каспаза-8 и каспаза-9, расщепляют эффекторные каспазы, например каспазу-3, в результате чего эффекторные каспазы активируются (трансактивация) и расщепляют другие эффекторные каспазы или специфические белки, выполняющие в клетке конкретную функцию. Расщепление специфических белков неизбежно приводит к гибели клетки путём апоптоза. Следовательно, программируемая клеточная гибель характеризуется чередой протеолитических реакций, или протеолитическим каскадом последовательного расщепления и активации каспаз. Переход от предшественников каспаз (прокаспаз) к активным каспазам осуществляется двумя путями: в результате взаимодействия лигандов с рецепторами смерти (рис. 4-12) и в ходе митохондриального пути. При активации прокаспаза расщепляется на большую и малую субъединицы, которые в конечном счете объединяются с образованием тетрамера из двух малых и двух больших субъединиц (рис. 4-13). Активные каспазы представляют собой тетрамеры, состоящие из двух малых (~10 кД) и двух больших (~20 кД) субъединиц. И те, и другие образуются в результате расщепления прокаспаз. Каспазы содержат активный сайт, представленный консервативной последовательностью QACXG, который, в свою очередь, включает активный сайт с остатком цистеина. При активации прокаспазы расщепление происходит тоже по остатку аминокислоты аспартат (Asp). Ингибиторный продомен, который содержит DED (Death Effector Domain) или CARD (Caspase RecruitmentDomain), отщепляется и удаляется.
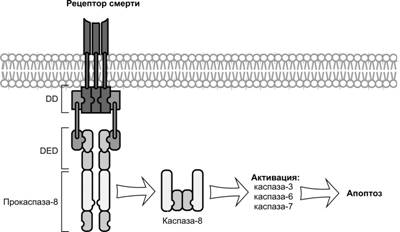
Рис. 4-12. Сигналы смерти активируют внутриклеточные сигнальные пути.В цитоплазматической части молекулы рецептора смерти присутствуют домены смерти DD (Death Domain), которые образуют тетрамерные комплексы с эффекторными доменами смерти DED(Death Effector Domain) в составе предшественника инициаторной каспазы-8. Этот комплекс назван смерть-индуцирующим сигнальным комплексом DISC (Death-Inducing Signaling Complex). Находясь в составе данного комплекса, прокаспаза-8 приобретает способность к активации путём аутопротеолитического расщепления, в результате которого образуется активная инициаторная каспаза-8. Она имеет гетеротетрамерную структуру, т.е. состоит из двух малых и двух больших субъединиц. Каспаза-8 активирует эффекторные каспазы, которые вовлекаются в апоптоз. [108]
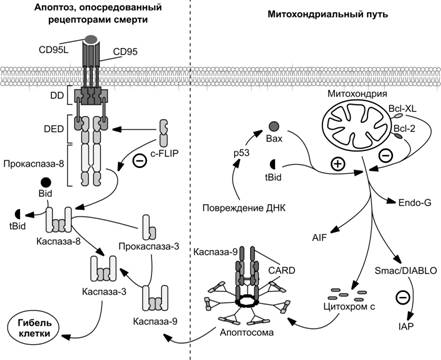
Рис. 4-13. Главные внутриклеточные пути реализации апоптоза: опосредованный рецепторами смерти и митохондриальный путь.Рецепторы смерти образованы молекулой CD95 (известной также, как Apo-1, или Fas) или представителями надсемейства рецепторов фактора некроза опухоли (TNF-R). Некоторые члены этого надсемейства имеют в составе молекулы домен смерти (DD). Этот домен участвует в белок–белковых взаимодействиях и обладает способностью связываться с адапторными белками, например белком FADD(Fas-Associated Death Domain). FADD содержит эффекторный домен смерти (DED). Аналогичный домен присутствует в составе неактивного профермента каспазы-8. При взаимодействии вышеупомянутых гомологичных доменов каспаза-8 связывается с FADD и формируется смерть-индуцирующий сигнальный комплекс DISC. В этом комплексе каспаза 8 олигомеризуется и активируется путём самопроцессинга. Имеющий гетеротетрамерную структуру активный фермент покидает DISC, в то время как продомен, содержащий два DED, остаётся в составе комплекса. Взаимодействие рецепторов смерти со своими лигандами CD–95L или фактором некроза опухоли (TNF) активирует каспазу-8. Опосредуемый рецепторами смерти апоптоз может быть заблокирован на уровне формирования DISC. Подобная картина, например, наблюдается в T–лимфоцитах. Для этой цели в геноме закодированы специальные белки, способные посредством собственных DED связываться с аналогичными доменами FADD и каспазы 8, препятствуя тем самым взаимодействию последних. Эти белки называются FLIPs (FLICE Inhibitory Proteins; FLICE — FADD–Like IL-1-Converting Enzyme). [95]
Расщепляя белки, каспазы могут их активировать, например другие каспазы, ICAD (Inactive Caspase-ActivatedDNase), или инактивировать, например протеинкиназу PKB/Akt, Raf-1 и PARP-1 (Poly (ADP-Ribose) Polymerase). В целом действует правило: белки, поддерживающие апоптоз, активируются, а белки, поддерживающие выживание, инактивируются.
Дата добавления: 2015-07-07; просмотров: 2932;
