И активация натриевых каналов.
Ацетилхолин, который является медиатором в таких синапсах, после синтеза заключается в мембрану и образует гранулы, одна гранула может содержать до 20000 молекул Ах. В покоящемся синапсе постоянно выделяется небольшое количество медиатора, который достигая постсинаптической мембраны вызывает миниатюрные потенциалы в пределах 5 – 10мв. Такие потенциалы поддерживают возбудимость мембраны. При деполяризации пресинаптической мембраны, когда ПД по нервному волокну достигает окончания аксона, происходит активация потенциал-зависимых Са-каналов. Именно поступивший в терминаль аксона кальций, активируя особые, кальций-связывающие белки – синапсины, активирует экзоцитозгранул медиатора в синаптическую щель. Ацетилхолин выделяется в синаптическую щель и взаимодействует с Н-холинорецепторами постсинаптической мембраны. Рецепторыпредставляют собой интегральные белки, состоящие из 5 субъединиц, расположенных вокруг натриевого ионного канала. Активация канала происходит при взаимодействии молекулы Ах с рецептором, при этом канал открывается и начинает пропускать ионы натрия (рис 6).
На рисунке 31внизу представлены этапы генерирования импульса возбуждения в мышечном волокне, а на рисунке 31 вверху изменения мембранных потенциалов пресинаптической мембраны, постсинаптической и возникновение ПД на мембране мышечного волокна.
Этапы возбуждения мышечного волокна:
1. Распространение ПД по нервному волокну от тела мотонейрона до синаптического окончания. Возникшая в результате деполяризация открывает потенциал-зависимые Са++ каналы в терминали аксона (пресинаптическая мембрана). Ионы Са++ поступают в клетку по градиенту концентрации.
2. Ионы Са++ , взаимодействуя со специальными белками – синапсинами, активируют экзоцитоз гранул с медиатором.
3. Ацетилхолин выделяется в синаптическую щель и взаимодействует с никотиновыми холинорецепторами (Н) на мембране мышечного волокна (постсинаптическая мембрана). Избыток медиатора разрушается АХ холинэстеразой до уксусной кислоты и холина. Связывание АХ с рецепторами приводит к открытию каналов для ионов, в результате ион натрия поступает в клетку, происходит деполяризация мембраны и возникает потенциал концевой пластинки (ПКП).
4. Потенциал действия возникает на соседнем участке мембраны в том случае, если разность потенциалов между зарядом мембраны на этом участке и на постсинаптической мембране достигнет такой величины, чтобы деполяризовать мембрану до критического уровня деполяризации. Как правило, в нервно-мышечных синапсах амплитуда ПКП всегда высока, не требует суммации и а всегда вызывает ПД.
5. ПД быстро распространяется по всей мембране мышечного волокна.
Передача команды к сокращению от возбужденной клеточной мембраны к миофибриллам в глубине клетки (электромеханическое сопряжение) включает в себя несколько последовательных процессов, ключевую роль в которых
играют ионы Ca++. Прежде, чем обсуждать роль ионов кальция в сокращении, остановимся на строении и функциональной характеристике сократительных и регуляторных белков саркомера.
Структурно-функциональная единица миофибриллы мышечного волокна – саркомер- содержит толстые и тонкие миофиламенты. Толстые миофиламенты образованы молекулами миозина, которые имеют четыре легкие цепи миозина и две тяжелые цепи, скрученные между собой. Тяжелые цепи миозина образуют головку миозина и шейку. Головка обладает АТФ-азной активностью, а шейка эластическими свойствами. В толстой филаменте 150 молекул миозина. Под электронным микроскопом на толстой миофиламенте видны выступы, расположенные под углом 120 градусов. Они получили название поперечных мостиков. Выяснилось, что эти мостики образованы головкой и шейкой молекул миозина, их длина 20 нм.
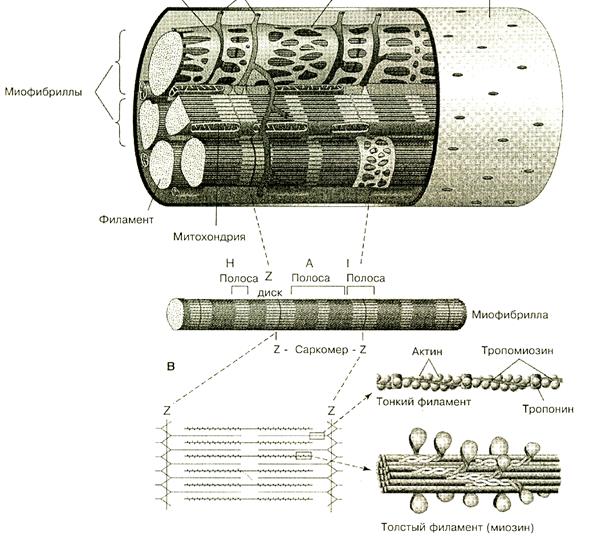
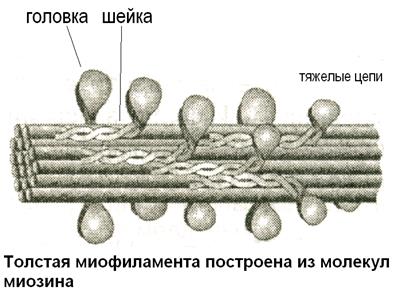
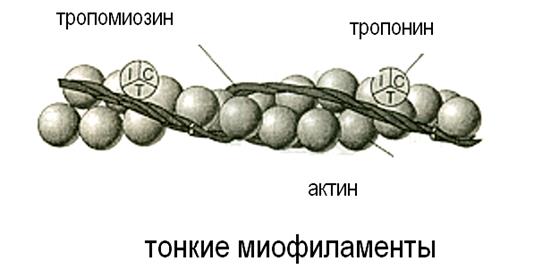
Рисунок 32 Уровни организации скелетной мышцы
Тонкие миофиламенты построены из глобулярных молекул белка актина. Мономеры актина взаимодействуют между собой и образуют фибриллярный актин. Актиновые филаменты представляют собой закрученную двойную спираль (похоже на две связки бус, которые перекручены с шагом в 14 молекул, примерно 36,5нм). Таких нитей в саркомере 2000. Эти нити одним концом прикреплены к Z- пластинке, а второй конец достигает середины саркомера.
В продольных бороздках актиновой спирали располагаются нитевидные молекулы белка тропомиозина. Тропомиозин закрывает активные центры на актиновых нитях.К молекуле тропомиозина равномерно прикреплены молекулы тропонина. Этот белок может связывать катионы Са++
Актин и миозин – это сократительные белки, а тропонин и тропомиозин – регуляторные.
На рисунке 33: а) Тропонин - тропомиозиновый комплекс закрывает активные центры на молекуле актина. б) При повышении концентрации ионов Са++ с 10-8 до 10-5 моль молекула тропонина, чувствительная к Са++, меняет свою конформацию так, что выталкивает тропомиозин и освобождает активные участки на молекуле актина. Головки миозина прикрепляются к активным участкам тонкой миофиламенты, в этот момент резко меняется положение головки миозина и она совершает гребковое движение. Благодаря этому тонкая миофиламента протягивается по направлению к центру саркомера примерно на 10 нм, происходит сближение Z полосок и укорочение мышцы.
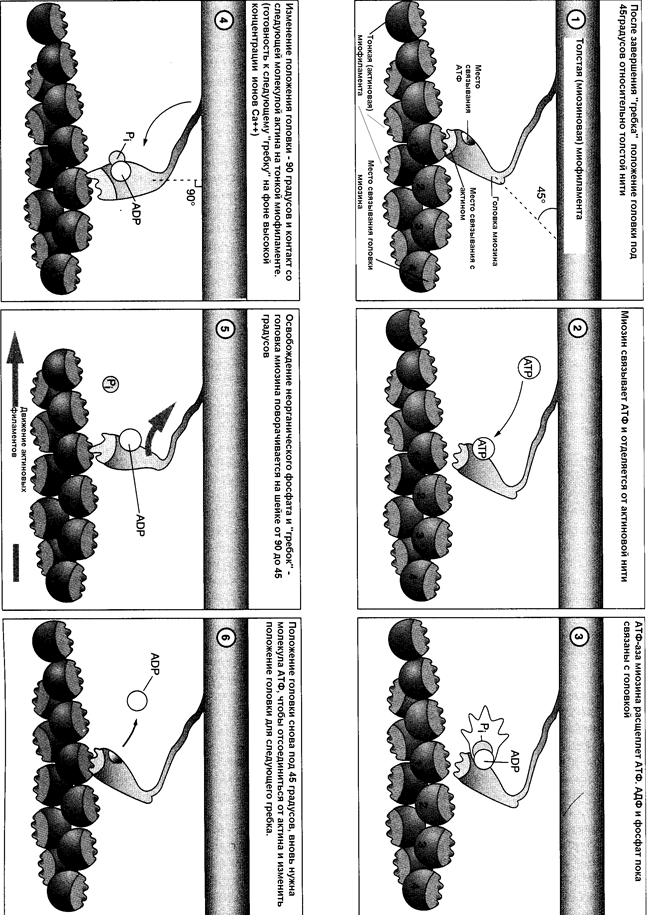
Обратите внимание на использование энергии АТФ в циклических гребковых движениях (рис.35). После завершения гребкового движения положение головки изменилось. Присоединение АТФ сопровождается отщеплением головки от актиновой миофиламенты, затем происходит гидролиз АТФ, высвобождение энергии и возвращение головки миозиновой молекулы в исходное состояние. Головка вновь готова к контакту, однако соединяется уже со следующим активным центром, и протягивает его с помощью очередного гребка. Таким образом, циклические движения тысяч головок миозина протягивают тонкие миофиламенты вдоль толстых.
На рисунке 34 представлен механизм повышения концентрации ионов кальция в цитоплазме и их роль в освобождении активных центров на молекулах актина. В результате становится возможен контакт головки миозина с тонкой миофиламентой. Гребковые движения, которые циклически выполняет головка с шейкой миозина обеспечивают передвижение актиновых нитей относительно миозиновых, сближаются Z- полоски, мышца укорачивается.
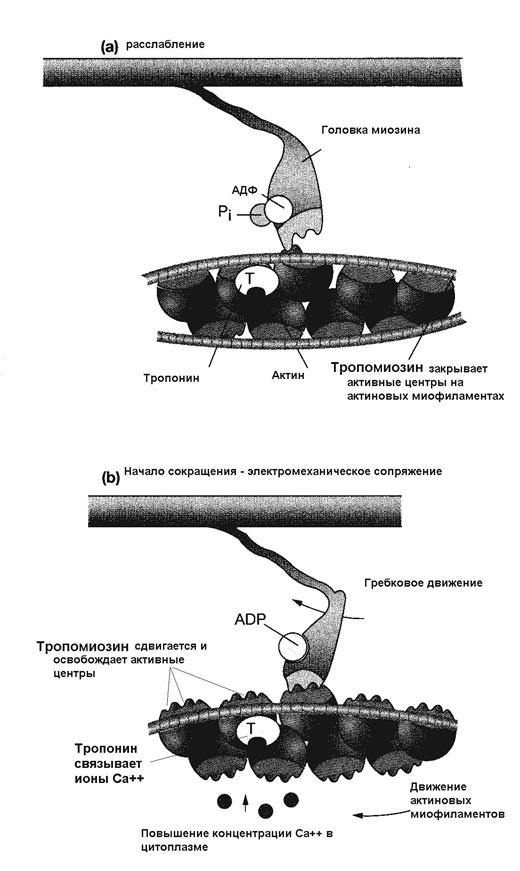
Рисунок 33 Роль регуляторных белков в сокращении мышц
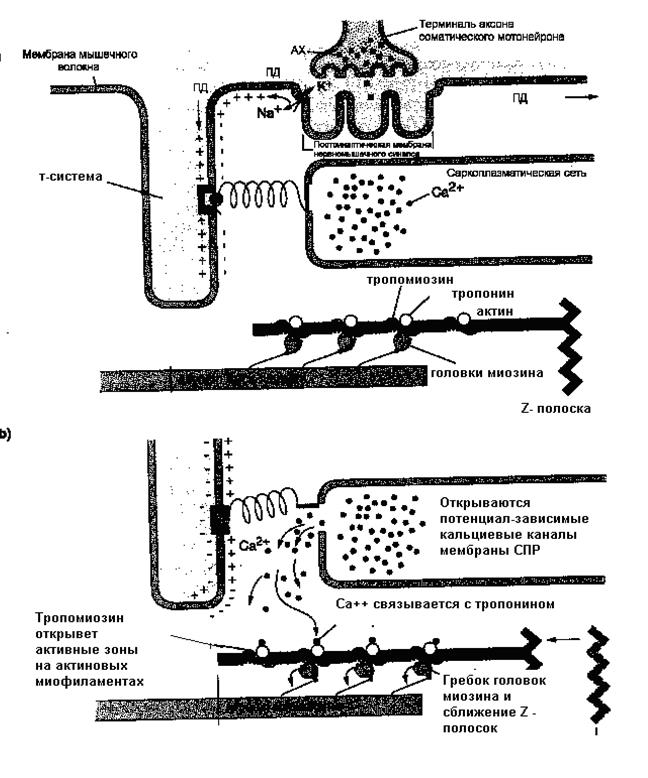
Рисунок 34 Роль кальция в сокращении мышц
Рисунок 35 Циклические движения головки миозина с использованием АТФ
Этапы генерирования сокращения склетной мышцы.
I) Потенциал действия пресинаптического окончания приводит к выделению медиатора. Кроме деполяризации мембраны пресинаптического волокна в процессе выделения медиатора большую роль играет входящий ток ионов Ca++, который так же вызывается деполяризацией пресинаптической мембраны
II) Возникновение ПКП на постсинаптической мембране.
III) Возникновение ПД - возбуждение мембраны.
IV) Электромеханическое сопряжение:
1) проведение возбуждения по Т-системе,
2) деполяризация мембраны саркоплазматического ретикулума (СПР) и активация кальциевых каналов,
3) высвобождение Ca++ из СПР,
4) взаимодействие Са++ с тропонином актиновых миофиламентов: под влиянием Са++ молекулы тропомиозина глубже опускаются в желобки между цепочками мономеров актина, открывая участки прикрепления для поперечных мостиков миозина,
5) контакт головки миозина с активным центром.
V) Скольжение актиновых миофиламентов относительно миозиновых осуществляется благодаря «гребковым» движениям головок миозина: циклическая активность миозиновых поперечных мостиков с расщеплением АТФ.
VI) Сближение Z полосок и укорочение саркомера.
Расслабление мышцы происходит пассивно, благодаря ее эластичности. Если к мышечному волокну не поступают импульсы возбуждения, ионы кальция больше в цитоплазму не выделяются. Имеющиеся в цитоплазме волокна ионы кальция перекачиваются в цистерны саркоплазматического ретикулюма с помощью кальциевой АТФ-азы – кальциевого насоса, который использует энергию АТФ для транспорта кальция из цитоплазмы в цистерны и в окружающую клетку среду против градиента концентрации. Снижение концентрации кальция приводит к блокировнию тропомиозином активных центров, контакт с головкой миозина невозможен, эластические компоненты мышечного волокна возвращают мышцу в исходное состояние.
Дата добавления: 2015-07-07; просмотров: 1590;
