ВАЖНЕЙШИЕ БЕЛКИ МЫШЕЧНОЙ ТКАНИ
МИОФИБРИЛЛЯРНЫЕ
1) МИОЗИН. ЕГО ХАРАКТЕРИСТИКА:
Молекула миозина построена из двух белковых цепочек, образующих «двойную спираль», так называемый «хвост» молекулы. Продолжением молекулы являются несколько коротких полипептидных цепочек, создающих глобулярную «голову» молекулы (рис. 2).
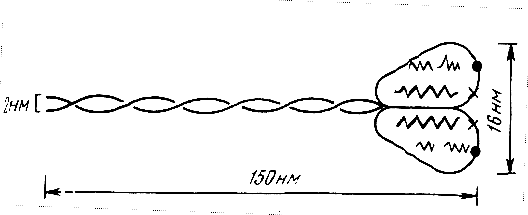

Рис. 3. Строение молекулы миозина
Соединяясь «хвост к хвосту», молекулы миозина образуют толстые нити (А-диски) миофибрилл.
Важнейшим свойством миозина является его способность катализировать расщепление АТФ:
 |
Выделяемая энергия (33,5 кДж/моль) расходуется для мышечного сокра-щения. АТФазная активность миозина характерна для «головы» молекулы.

Рис. 4. Схема строения толстого миозинового филамента.
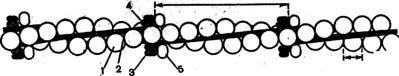
Рис 5. Структура тонкого филамента.
1 —актин; 2 — тропомиозин; 3 — тропонин-С: 4 — тропонин-l;
в — тропонин-Т.
2) АКТИН. ЕГО ХАРАКТЕРИСТИКА:
|
 Актин обладает свойством существовать в двух формах:
Актин обладает свойством существовать в двух формах:
глобулярной (Г-актин) с молекулярной массой 46000
фибриллярной (Ф-актин) с молекулярной массой 1500000.
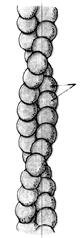
Обе формы могут переходить друг в друга, причем F-актин является полимеризованным, нитевидным производным G-актина с двухспиральной структурой.
Каждая спираль состоит из 200-300 глобул G-актина (рис. 3). Этот переход осуществляется под влиянием критических концентраций ионов кальция и магния.
|
АКТОМИОЗИН - это сложный комплекс, состоящий из белков актина (1/3) и миозина (2/3).
При образовании актомиозина молекулы миозина прикрепляются своими «головами» к глобулам двойной спирали актина, а «хвост» располагается виде спирали вдоль оси актомиозина.
В зависимости от физиологического состояния мышц миозин может находиться или в комплексе с актином, или в диссоциированном состоянии.
В присутствии АТФ и в зависимости от ее концентрации актомиозин частично или полностью диссоциирует на актин и миозин. Это явление тесно связано с сокращением и посмертным окоченением мышц.
Актомиозин растворим в растворах солей высокой концентрации.
Температура денатурации белка 42-48 оС.
САРКОПЛАЗМАТИЧЕСКИЕ
МИОГЛОБИН
· сложный белок хромопротеид;
· растворим в воде;
· изоэлектрическая точка рН=7,0;
· температура денатурации 60-70оС;
· полноценный белок.
Миоглобин играет важную роль в формировании окраски мяса и мясопродуктов.
Миоглобин построен из белковой части - глобина (94 %) и простетической - гема (6 %).

Рис. 7. Молекула миоглобина
Основой гема является протопорферин, построенный из 4-х пирольных колец, объединенных в молекулы кольцевой формы.
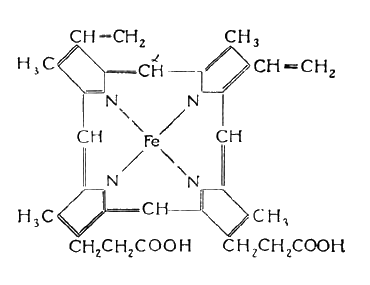
Центральное место в молекуле гема занимает атом железа, имеющий 6 координационных связей:
? одну - с молекулой глобина,
? четыре - с атомами азота пирольных колец,
? шестая связь участвует в образовании комплексов миоглобина с различными соединениями (О2, Н2О, NО, СО и др.).
Миоглобин легко соединяется с некоторыми газами (О2, СО2, NO и др.), образуются производные миоглобина:
• оксимиоглобин (МЬ О2) ало-красного цвета,
• карбоксимиоглобин (МЬСО) вишнево-красного цвета,
• нитрозомиоглобин (MbNO) красного цвета.
При действии сильных окислителей (кислорода, пероксида водорода и др.) миоглобин переходит в метмиоглобин (ММЬ) коричневого цвета ПРИ ЭТОМ ЖЕЛЕЗО ОКИСЛЯЕТСЯ ДО ТРЕХВАЛЕНТНОЙ ФОРМЫ .
Метмиоглобин может быть восстановлен в миоглобин только под действием сильных восстановителей, например, аскорбиновой кислоты. Процесс восстановления представлен на рисунке.
 |
Количественное соотношение этих трех форм белка:
? нативного миоглобина (Мв),
? оксимиоглобина (МвО2) и
? метмиоглобина (МеtМв)
ОПРЕДЕЛЯЕТ ЦВЕТ МЯСА.
Установлено, что при содержании МеtМв больше 50 % от общего количества Мв в мясе цвет его становится серо-коричневым.
Содержание миоглобина в мышечной ткани зависит от вида мяса, анатомического происхождения мышц, что объясняется различиями в интенсивности их прижизненной физической нагрузки.
Таким образом, цвет мяса и его интенсивность зависят от концентрации миоглобина в мышечной ткани и от количественного соотношения различных форм этого белка. Так как окраска мяса может изменяться под влиянием различных факторов, для ее стабилизации используют специальные технологические приемы.
БЕЛКИ СТРОМЫ
КОЛЛАГЕН.
Коллаген составляет 25—33% от общего количества белка организма взрослого человека или 6% от массы тела.
Коллагеновые волокна состоит из волокнистого белка — коллагена (colla — клей, gennao — я произвожу), получившего название из-за свойства прекращаться при длительном варении вживотный клей - желатин.
Субъединица коллагенового волокна - белковая молекула тропоколлагена.
Тропоколлаген содержит три полипептидные цепи, которые сливаются в спиралевидный триплет.
Волокна имеют продольную исчерченность, так как состоят из тонких коллагеновых фибрилл.

Рис. 8. Схема строения коллагенового волокна.
А – спиральная структура макромолекулы коллагена (по Ричу):
мелкие светлые кружки – глицин,
крупные светлые кружки – пролин,
заштрихованные кружки – оксипролин.
Б – схема строения коллагеновых волокон (по Ричу):
1 – пучок фибрилл;
2 – фибрилла;
3 – протофибрилла;
4 - молекула коллагена.
Коллаген - неполноценный белок в нём мало тирозина и метионина, нет триптофана и цистеина.
Отличительной особенностью коллагена является то, что почти ¼ всех аминокислотных остатков представлена глицином, ¼ - пролином и оксипролином.
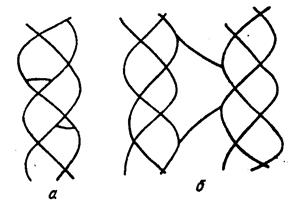 Нерастворимость и устойчивость объясняются наличием поперечных связей в молекуле коллагена (рис. 9).
Нерастворимость и устойчивость объясняются наличием поперечных связей в молекуле коллагена (рис. 9).
Рис. 9. Поперечные связи в молекуле коллагена:
а - внутримолекулярные поперечные связи;
в - межмолекулярные поперечные связи
Нерастворимость и устойчивость коллагена меняются в зависимости от вида и возраста животного, а также от ткани, в которой он содержится.
С увеличением возраста животного количество поперечных связей в коллагене возрастает и его устойчивость повышается. Он может сильно набухать, при этом его масса увеличивается в 1,5 - 2 раза. По набухаемости коллаген уступает только миозину.
Изоэлектрическая точка коллагена шкуры животных разного возраста неодинакова: для коллагена шкуры теленка она соответствует рН 6,36, шкуры крупного рогатого скота - 7,0.
[1] НАПИСАННОЕ СИНИМ И РИСУНКИ, В ОБРАМЛЕНИИ СИНЕГО ТЕКСТА – НЕ ПЕРЕРИСОВЫВАЙТЕ И НЕ СПИСЫВАЙТЕ.
ДЛЯ ОБЩЕГО РАЗВИТИЯ
Дата добавления: 2015-07-07; просмотров: 4250;
