Химический потенциал
В открытых системах изменение внутренней энергии 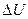 происходит не только в результате получения или отдачи теплоты и совершения работы, но и за счёт изменения масс, входящих в систему компонентов. Все свойства открытых систем и ΔG будут зависеть от количества каждого компонента:
происходит не только в результате получения или отдачи теплоты и совершения работы, но и за счёт изменения масс, входящих в систему компонентов. Все свойства открытых систем и ΔG будут зависеть от количества каждого компонента:
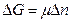 ,
,
где ΔG энергия Гиббса, 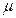 – химический потенциал,
– химический потенциал, 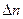 – изменённое количество вещества системы выраженное в молях.
– изменённое количество вещества системы выраженное в молях.
Химический потенциал – интенсивный параметр состояния. В условиях, 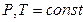 и сохранения количеств всех других компонентов, μ равен частной производной энергии Гиббса по количеству компонента:
и сохранения количеств всех других компонентов, μ равен частной производной энергии Гиббса по количеству компонента:
μi = (∂G/∂ni)P,T, i ≠j
Если в системе 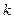 – компонентов, то
– компонентов, то 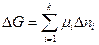 .
.
Химический потенциал зависит от парциального давления компонента (для газов) или от его концентрации в растворе:
μi = μio+ RTlnpi;
μi = μio+ RTlnci,
здесь μio стандартное значение химического потенциала, полученное при стандартных условиях и единичных концентрациях или давлениях.
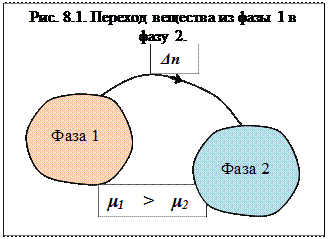
Рассмотрим химически однородную гетерогенную систему (состоящую из одного компонента). Пусть в этой системе имеется граница раздела между фазами 1 и 2 (рис. 5.6). Если из фазы 1 в фазу 2 переходит 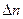 вещества, то изменение энергии Гиббса в фазе 1 будет равно: ΔG1 = -μ1Δn, а в фазе 2: ΔG2 = μ2Δn (знак минус указывает на убыль энергии, + на ее увеличение). Общее изменение энергии системы будет равно их сумме:
вещества, то изменение энергии Гиббса в фазе 1 будет равно: ΔG1 = -μ1Δn, а в фазе 2: ΔG2 = μ2Δn (знак минус указывает на убыль энергии, + на ее увеличение). Общее изменение энергии системы будет равно их сумме:
ΔG = -μ1Δn + μ2Δn
Для того чтобы фазовый переход произошел ΔG < 0, что возможно при условии:
-μ1Δn + μ2Δn< 0, или μ1 > μ2
Отсюда следует вывод – фазовый переход компонента осуществляется из фазы с большим химическим потенциалом в фазу с меньшим.
Равновесие между фазами возможно только в том случае, когда химические потенциалы компонента в этих фазах равны:
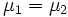 .
.
Данный вывод можно распространить для общего случая перехода вещества из какой-либо системы в окружающую среду (открытые системы) и записать его так:
независимо от числа компонентов открытой системы возможен переход любого из них в другую фазу окружающей среды и, наоборот, при условии выравнивания химических потенциалов этого компонента в фазах системы и среды. При равенстве химических потенциалов наступает равновесие между фазами – сколько вещества уходит из системы, столько же и возвращается.
Дата добавления: 2015-07-30; просмотров: 806;
