И свинцово-кислотном аккумуляторе.
Химический источник тока создается на основе определенной электрохимической системы, которой называется совокупность реагентов (окислителя и восстановителя) и электролита. Восстановитель электрохимической системы в процессе рабочей реакции (называемой также токообразующей) отдает электроны и окисляется (отрицательный электрод), а окислитель восстанавливается (положительный электрод). Электролитом служит, как правило, жидкостное химическое соединение, обладающее хорошей ионной проводимостью и крайне малой электронной.
Условная запись электрохимической системы:
(—) Восстановитель |Электролит| Окислитель (+)
В свинцово-кислотных аккумуляторах восстановителем служит губчатый свинец Рв , а окислителем – двуокись свинца РвО2 . Электролит — водный раствор серной кислотыН2SО4 с массовой концентрацией от 28 до 40 %. Таким образом, условная запись рассматриваемой электрохимической системы
(—)Рb| Н2SО4| РbО2(+)
Физические процессы, происходящие в аккумуляторе, связаны со свойством электролитического растворения металлов, которое заключается в переходе положительно заряженных ионов металла в раствор. Причем легкоокисляющиеся металлы (свинец) обладают этим свойством в большей степени, чем трудноокисляющиеся. При погружении электрода, на котором образовался свинец, в раствор электролита от свинца начнут отщепляться положительно заряженные ионы свинца и переходить в раствор, при этом электрод будет заряжаться отрицательно. По мере протекания процесса возрастает разность потенциалов раствора и электрода, следовательно, возрастает и осмотическое давление положительных ионов раствора. Вследствие этого переход ионов свинца в раствор не может продолжаться долго и при какой-то определенной разности потенциалов электрода и раствора наступит равновесие между силой электролитической упругости растворения свинца, с одной стороны, и силами электростатического поля и осмотического давления — с другой. В результате растворение свинца прекратится.
При погружении положительного электрода в раствор серной кислоты происходит го же явление, но результат получается иной. Двуокись свинца положительного электрода. в ограниченном количестве переходит в раствор, где при соединении с водой ионизируется на четырехвалентные ионы свинца Рв4+ иодновалентные ноны гидроокисла ОН-. Четырехвалентные ноны свинца, осаждаясь на электроде, создают положительный потенциал относительно раствора.
Химические процессы в свинцово-кислотном аккумуляторе описываются теорией «двойной сульфитации», разработанной еще в 1883 г. Дж. Глад стоном и А. Трайбом.
При указанных концентрациях серная кислота диссоциирует в воде практически только на ионы Н+ и HSO4 . Поэтому реакции на электродах описываются следующими уравнениями:
(+)PbO2+3H++HSO-4+2e 
 PbSO4+2H2O;
PbSO4+2H2O;
(-)Pb+HSO-4 
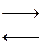 PbSO4+H++2e
PbSO4+H++2e
Общая токообразующая реакция в аккумуляторе:
PbO2+Pb+2H2SO4 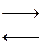 2PbSO4+2H2O
2PbSO4+2H2O
Таким образом, при разряде аккумулятора расходуется серная кислота, образуется вода, а на обоих электродах — сульфат свинца. При заряде процессы протекают в обратном направлении
Большое значение для работы электродов имеет их пористая структура, обеспечивающая доступ электролита в глубину электрода. Средний диаметр пор положительного электрода равен 1 ... 2 мкм, отрицательного— 10 мкм.
В ходе разряда пористость сильно уменьшается, так как удельный объем сульфата свинца больше удельных объемов свинца и двуокиси свинца.
Для свинцово-кислотных аккумуляторов характерно сильное разбавление электролита во время разряда из-за потребления серной кислоты и образования воды. Поэтому измерение плотности или концентрацииэлектролита служит удобным и точным средством определения степени заряженности аккумулятора.
Помимо основных рабочих реакций, в аккумуляторах протекают также и побочные реакции, уменьшающие КПД рабочих процессов и, как правило, отрицательно сказывающиеся на работоспособности батареи. Одной из основных побочных реакций является электролиз воды и связанное с ним газовыделение кислорода и водорода. Выделение газов на электродах происходит главным образом при заряде, а также в процессе разряда и хранения батареи; при этом выделение кислорода происходит на положительном электроде, а водорода — на отрицательном. Этот процесс определяется разностью между потенциалом электрода инапряжением начала выделения газа (так называемое «перенапряжение газа»). Чем больше «перенапряжение», тем больше интенсивность газовыделения, и наоборот. На величину напряжения начала газовыделения значительное влияние оказывают примеси, содержащиеся в активных материалах, а также в конструкционных материалах электродов. Примеси, понижающие напряжение начала газовыделения, увеличивают его интенсивность, что приводит к быстрому снижению уровня электролита в аккумуляторе из-за «выкипания» и требует частого его долива в процессе эксплуатации.
Дата добавления: 2015-07-30; просмотров: 1034;
