Капиллярные силы
Молекулярные силы взаимодействия между различными веществами, насыщающими горные породы, играют важную роль в процессах извлечения нефти и газа из недр. Капиллярные силы представляют собой одну из форм проявления межмолекулярных сил.
Характер молекулярного взаимодействия зависит от природы вещества. При нормальных расстояниях между молекулами вещества (при нормальных давлении и температуре) взаимодействие молекул выражается в притяжении их друг к другу. При сильном сближении молекул возникают силы отталкивания.
Сила взаимодействия молекул Fo сильно зависит от расстояния г между молекулами при малых г.
Функция Fo (r) для простых молекул, имеющих сферическую форму, имеет вид, показанный на рис. 5.1. Представим себе две жидкости А и В, настолько диспергированные одна в другой, что их молекулы равномерно распределены в объеме, который занимают эти жидкости.
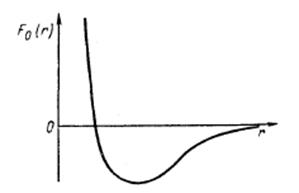
Рис. 5.1
Пусть молекулы жидкости В сильнее притягиваются к молекулам жидкости А, чем между собой. Тогда любое случайное скопление молекул В (рис. 35) окажется недолговечным — молекулы жидкости А «растащат» молекулы жидкости В. Жидкость В является в данном случае полностью растворимой в жидкости А.
Если же взаимное притяжение молекул жидкости В намного больше притяжения молекул жидкости В к молекулам жидкости А или если между этими разносортными молекулами существуют силы отталкивания, то скопление молекул жидкости В, находящихся в жидкости А, будет устойчивым. Такие жидкости называются взаимно нерастворимыми или несмешивающимися. Следовательно, характер взаимодействия молекул различных веществ определяет их взаимную растворимость.
Рассмотрим схематично молекулы двух взаимно нерастворимых веществ, находящихся в соприкосновении друг с другом (рис. 5.2). Будем считать, что молекулы жидкостей А и В испытывают взаимное отталкивание, причем силы отталкивания действуют в направлении, перпендикулярном поверхности раздела жидкостей. Молекулы А и В испытывают также притяжение в сторону той жидкости, которой они принадлежат. Допустим теперь, что молекулы жидкости В,
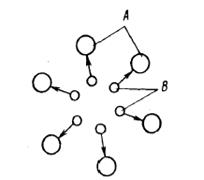
Рис.5.2 Взаимное притяжение молекул А и В
находившиеся первоначально в сильно диспергированном состоянии в жидкости А, собрались в одну каплю. В том случае, когда молекулы жидкости В были сильно диспергированы в жидкости А, они обладали большей потенциальной энергией, чем когда собрались
|
Итак, молекулы жидкости В, находящиеся на границе с жидкостью А, будут испытывать отталкивание от молекул жидкости А и притяжение со стороны молекул жидкости В (см. рис. 5.2). Таким образом, возникнет состояние, аналогичное тому, как будто бы капля жидкости В сжимается упругой оболочкой. В результате ( давление внутри капли не будет равно давлению в жидкости А, окружающей каплю.
Рассматривая поверхностные силы, действующие на границе раздела двух жидкостей в капле, содержащей большее число молекул, можно уже не учитывать взаимодействие отдельных молекул, а перейти к использованию понятий, свойственных механике сплошных сред. Учитывая это, рассмотрим участок поверхностей, разделяющих две жидкости в капле (рис. 5.3).

Рис.5.3 Действие усилий на элемент поверхности
раздела жидкостей А и В.
Верхний элемент поверхности относится к жидкости А, а нижний — к жидкости В; dl1 и dl2 — длины дуг поверхности, имеющие радиусы R1 и R2, a α — угол между соответствующими направлениями радиуса. Из равновесия этого участка поверхностей вытекает, что к единице длины сечения внешней оболочки капли должны быть приложена сила σа, а к внутренней оболочке – сила σв.
Условие равновесия поверхностей раздела двух жидкостей выражается формулой Лапласа
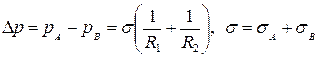 (5.1)
(5.1)
Величина σ называется поверхностным натяжением на границе раздела двух жидкостей. Поверхностное натяжение имеет размерность силы, отнесенной к расстоянию. Его можно определить также как энергию, приходящуюся на единицу поверхности раздела между двумя жидкостями.
Если капля жидкости В имеет форму шара, то R1 = R2, и из формулы (5.1) получаем формулу Кельвина
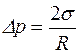 . (5.2)
. (5.2)
Поверхностное натяжение (σ) характеризует избыток свободной энергии, сосредоточенной на одном квадратном сантиметре площади поверхностного слоя на границе раздела двух фаз или работу образования новой поверхности в изотермических условиях:
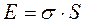 . (5.3)
. (5.3)
Величину коэффициента поверхностного натяжения можно определить как величину работы, необходимой для образования 1 см2 новой поверхности (Дж/м2, Н/м).
Поверхностное натяжение является свойством не отдельно взятого вещества, а свойством поверхности контакта двух или большего числа веществ. Можно говорить, например, о поверхностном натяжении воды на границе с воздухом или на границе с нефтью, однако без указания контактирующего с водой вещества понятие поверхностного натяжения теряет смысл. Одно и то же вещество может иметь различные величины поверхностного натяжения на границе с различными веществами. Так, вода на границе с воздухом имеет поверхностное натяжение 75·10~3Н/м, а на границе с нефтью – около 30·10~3Н/м.
По поверхностному натяжению пластовых жидкостей на различных поверхностях раздела можно судить о свойствах соприкасающихся фаз, о закономерностях взаимодействия жидких и твердых тел, о процессах адсорбции, о количественном и качественном составе полярных компонентов в жидкости, об интенсивности проявления капиллярных сил и т. д. Влияние температуры и давления на поверхностное натяжение жидкостей можно установить исходя из молекулярного механизма возникновения свободной поверхностной энергии и энергетической сущности поверхностного натяжения.
Коэффициент поверхностного натяжения (σ) зависит от давления, температуры, газового фактора, свойств флюидов. Поверхностное натяжение с увеличением давления понижается, тем сильнее, чем ниже температура. Поверхностное натяжение уменьшается с повышением температуры. Общий характер изменения величины поверхностного натяжения с изменением давления (рис. 5.4) и температуры для нефти такой же, как и у воды.
Влияние этих факторов на величину поверхностное натяжение (σ) можно установить исходя из молекулярного механизма возникновения свободной поверхностной энергии и энергетической сущности поверхностного натяжения. С увеличением давления величина (σ) жидкости на границе с газом понижается. С повышением температуры происходит ослабление межмолекулярных сил и величина поверхностного натяжения чистой жидкости (чистой воды) на границе с паром уменьшается.

Рис. 5.4 Зависимость поверхностного натяжения
небитдагской нефти от давления
1 – на границе с метаном (при t = 20°С);
2 – на границе с метаном (при t = 60°С);
3 – на границе с этан-пропановой смесью.
С увеличением количества растворенного газа в нефти величина поверхностного натяжения нефти на границе с газом уменьшается, а на границе с водой возрастает.
Количественные изменения величины поверхностного натяжения зависят от многих дополнительных факторов: химического состава нефти, состава газа (рис. 5.4, кривая 3), количества растворенного газа, количества и природы полярных компонентов и других факторов.
Поверхностное натяжение нефти на границе с водой или другой жидкостью зависит от следующих факторов.
1. От количества имеющихся в ней поверхностно-активных компонентов: асфальтенов, смолистых веществ, нафтеновых кислот. Нефть, содержащая наименьшееколичество указанных веществ, имеет наибольшую величину поверхностного натяжения на границе с водой. Наоборот, нефти, содержащие наибольшее количество поверхностно-активных веществ, имеют наименьшую величину поверхностного натяжения на границе с водой. Эта закономерность объясняется физическим смыслом величины поверхностного натяжения.
2. От природы другой жидкости, с которой нефть соприкасается. Например, при соприкосновении с водой в большинстве случаев поверхностное натяжение нефти меньше, чем при соприкосновении с воздухом. Чем выше плотность нефти, тем больше ее поверхностное натяжение на границе с воздухом и тем меньше на границе с водой.
Поверхностное натяжение большинства пластовых вод гидрокарбонатного типа (воды щелочные) на границе с некоторыми нефтями весьма невелико, от 1 до 7,5 мН/м (идёт диспергирование фаз).
Хлоркальцевый тип вод (жесткие пластовые воды, кислые по природе) имеет более высокие значения величин поверхностного натяжения на границе с пластовой нефтью, от 7 до 14 мН/м.
Морская вода на границе с нефтью продуктивной толщи Апшеронского полуострова имеет также высокое поверхностное натяжение, от 14 до 23 мН/м.
Дата добавления: 2015-07-18; просмотров: 1784;
