Группировка по стадиям. Клиническая картина и данные объективного исследования

Клиническая картина и данные объективного исследования
Плохие результаты лечения РПЖ связаны, прежде всего, с поздней его диагностикой. Клиническая картина заболевания чаще всего развивается постепенно. Средняя длительность клинических проявлений до установления диагноза составляет 2–4 мес. К основным начальным (в дожелтушной фазе заболевания при раке головки ПЖ), хотя и далеко не ранним проявлениям рака ПЖ относят дискомфорт в верхней части живота в виде чувства тяжести и переполнения желудка, особенно после еды, а также боли, потерю массы тела, снижение аппетита и тошноту. Неспецифичность этих симптомов часто является причиной поздней диагностики заболевания. К классическим, хотя обычно и более поздним симптомам РПЖ, относятся желтуха, потеря массы тела и боль в животе.
Клиническая картина зависит от локализации опухоли. Ведущими клиническими симптомами рака головки ПЖ являются желтуха, обычно появляющаяся без болевого приступа (92–98 %), потеря массы тела (65–80 %) и боли (45–65 %). При раке тела и хвоста чаще всего отмечаются потеря массы тела (более 90 %) и боли (более 70 %). Вместе с тем нами отмечено, что при раке КО, в отличие от рака головки железы, к которому, как уже упоминалось, его относят, наиболее частыми жалобами больных являются боли (70 %) и потеря массы тела (50 %), а желтуха встречается крайне редко (около 15 %) и является более поздним симптомом.
При описании клинической картины РПЖ нередко начинают с синдрома механической желтухи, так как это наиболее яркий и частый синдром при раке головки ПЖ, который, как уже указывалось, встречается более чем в 70 % случаев РПЖ. Механическая желтуха нередко является первым, но, к сожалению, не ранним признаком, с появлением которого заболевание переходит во вторую (желтушную) фазу. Механическую желтуху не всегда легко отличить от паренхиматозной, так как в обоих случаях обычно не развивается болевой синдром. До 80 % больных с синдромом желтухи первоначально госпитализируют в инфекционные стационары. При этом иногда на установление характера желтухи затрачивается более 4 недель, что приводит к развитию печеночной недостаточности, резко ухудшает непосредственные результаты оперативного лечения и онкологический прогноз. Желтуха отмечается в 90 % случаев рака головки ПЖ. Для механической желтухи при раке головки ПЖ характерно неуклонное прогрессирование билирубинемии. Время появления желтухи при раке головки ПЖ зависит от близости опухоли к общему желчному протоку: чем ближе к нему локализуется опухоль, тем раньше появляется желтуха и наоборот. Застой желчи в желчевыводящей системе способствует присоединению энтерогенной инфекции, развитию холангита. Холестаз и инфекционный процесс вызывают тяжелые изменения в печени, что приводит к нарушению ее функции и может явиться причиной смерти больных в послеоперационном периоде. Сдавление опухолью v. portae приводит к развитию портальной гипертензии. Нарушение поступления желчи в кишечник вызывает расстройство пищеварения. Развивается кишечника, снижается иммунологическая защита организма, появляется токсемия.
В 45–60 % случаев желтухе сопутствует кожный зуд. Его интенсивность не зависит от выраженности желтухи. Появлению этого зуда способствует увеличение содержания в крови гистаминоподобных веществ и желчных кислот. В ряде случаев кожный зуд может появиться в дожелтушном периоде и быть первым признаком холестаза.
Возникновение потери массы тела связано, с одной стороны, с самим опухолевым процессом, вызывающим снижение аппетита и повышение основного обмена на 50–70 %, а с другой – со сдавлением опухолью главного панкреатического протока, что приводит к нарушению пищеварения, обусловленному недостаточным поступлением в ДПК панкреатических ферментов и желчи.
При опухолях головки ПЖ боль чаще локализуется в области эпигастрия и в правом верхнем квадранте живота, при опухолях тела – по средней линии, а хвоста – в левом верхнем квадранте. Боль может быть слабой, упорной, тупой, резкой или же сверлящей, иррадиирующей в спину. На относительно ранних стадиях рака боль встречается у 30^0 % больных и связана со сдавлением главного панкреатического протока, развитием панкреатической гипертензии и панкреатита. Сильная некупируемая боль свидетельствует о распространении опухоли на забрюшинное пространство и инвазии в нервные сплетения.
Диспептические симптомы – анорексия, тошнота, рвота, поносы, запоры, метеоризм наблюдаются примерно у 40 % больных. Они связаны с холестазом и секреторной недостаточностью ПЖ.
Слабость, повышенная утомляемость – являются следствием расстройств питания, анемизации, нарушения обмена веществ.
Повышение температуры тела – наблюдается в 30 % случаев. Чаще всего этот симптом является следствием развития вторичного воспалительного процесса – холангита и панкреатита. Реже температура тела повышается из‑за нарушения терморегуляции при раке.
При объективном исследовании часто выявляют похудание, желтуху, увеличение размеров и болезненность печени. При обтурационной желтухе появляется темная моча (наличие желчных пигментов) и обесцвеченный глиноподобный кал. Несмотря на увеличение желчного пузыря при холестазе, он пальпируется только в 40–60 % случаев ( симптом Курвуазъе). Увеличенный и безболезненный желчный пузырь желтушного больного, отсутствие предшествующей желтухе печеночной колики заставляет предположить злокачественную обтурацию дистальных отделов внепеченочных желчных протоков.
Спленомегалия может быть результатом портальной гипертензии, развивающейся вследствие сдавления, опухолевой инфильтрации или тромбоза воротной и селезеночной вен (подпеченочный портальный блок). При распаде рака БДС, прорастании в ДПК опухоли головки ПЖ могут наблюдаться кровотечения. Опухоль, располагающаяся в области тела и хвоста железы, пальпируется примерно у 40–50 % больных, что является плохим прогностическим признаком, свидетельствующим о большой распространенности процесса. Гепатомегалия, связанная с холестазом, чаще определяется при опухолях головки, а бугристость поверхности печени свидетельствуют
о наличии в ней метастазов. К физикальным признакам РПЖ относится систолический шум , который можно слышать под мечевидным отростком или чуть левее. Он объясняется инвазией опухоли и/или сдавлением ею чревного ствола и/или селезеночной артерии и поэтому, как правило, является признаком значительного местного распространения опухоли.
Раковая опухоль способствует повышению свертываемости крови, поэтому при РПЖ иногда возникают периферические тромбофлебиты . Этому способствует и проникновение из ПЖ железы в кровь трипсина, повышающего активность свертывающей системы. Тромбофлебиты встречаются приблизительно у 10 % больных, причем чаще при опухолях тела или хвоста ПЖ.
Асцит при РПЖ возникает вследствие метастазирования опухоли по брюшине, сдавления воротной вены, массивного метастатического поражения печени, прогрессирующей гипопротеинемии. При ацинарно‑клеточной карциноме, которая встречается редко (в 1–3 % случаев), под кожей могут появляться болезненные узелки, обусловленные очаговым некрозом подкожной клетчатки, а также боли в суставах.
Описанные симптомы, как уже указывалось, являются довольно поздними и выполнить радикальную операцию можно лишь 10–20 % больных. Однако в редких случаях внезапно развившийся сахарный диабет или острый панкреатит у больных старше 50 лет могут быть первыми проявлениями рака этой локализации. Иногда они отмечаются за 1–2 года до появления других клинических признаков. Развитие сахарного диабета на ранних стадиях связывают с выработкой опухолью супрессора периферических рецепторов инсулина. Панкреатит бывает первым проявлением заболевания, если опухоль локализуется в главном панкреатическом протоке или близко от него, рано вызывая нарушения оттока сока ПЖ.
Таким образом, исходя из изложенного выше, рак поджелудочной железы следует подозревать у больного в возрасте старше 50 лет, у которого определяется любой из следующих клинических признаков (в порядке убывания значимости): 1) желтуха, возникшая без болевого приступа; 2) необъяснимое уменьшение массы тела более чем на 10 %; 3) необъяснимая боль или дискомфорт в верхнем отделе живота, особенно при отрицательных результатах рентгенологического и эндоскопического исследования верхних отделов желудочно‑кишечного тракта; 4) необъяснимые боли в пояснице;
5) приступ панкреатита без видимой причины (отсутствия алкогольного анамнеза, ЖКБ, погрешности в диете, травмы и т. д.);
6) экзокринная недостаточность ПЖ без очевидной причины, проявляющаяся неустойчивым стулом, частыми поносами; 7) внезапное начало сахарного диабета без предрасполагающих факторов, таких как ожирение или наследственный анамнез.
Лабораторная и инструментальная диагностика
Данные традиционных лабораторных исследований чаще всего не специфичны для РПЖ.
Анемия встречается у половины больных РПЖ и объясняется угнетением кроветворения и/или нередко сопутствующим эрозивным дуоденитом, прорастанием опухоли и кровотечением из нее в просвет ДПК. Лейкоцитоз отмечается только при развитии холангита и деструктивного панкреатита. Каловые массы имеют характерный «жирный» блеск и мягкую консистенцию. Стеаторея определяется у 10–20 % больных. Уровень амилазы и липазы в сыворотке крови повышается в 10 % случаев. Рак головки ПЖ с обструкцией желчного протока сопровождается гипербилирубинемией (с преобладанием прямой фракции). Холестаз приводит к глубоким нарушениям обмена липидов, вследствие чего отмечается увеличение содержания холестерина в сыворотке крови. При опухолевой желтухе повышение щелочной фосфатазы (ЩФ) в 5‑10 раз отмечается в 90 % случаев, причем примерно в трети случаев это может произойти и до появления гипербилирубинемии. Содержание ЩФ повышается как в результате нарушения естественного пути ее выведения и экскреции гепатоцитами, так и вследствие резкого увеличения синтеза пролиферирующим эпителием желчных канальцев. При длительной механической желтухе отмечается диспротеинемия и гипопротеинемия , снижение уровня протромбина. Содержание AJ1T и ACT у большинства больных бывает повышенным не более чем в 5‑10 раз, что используется для дифференциальной диагностики с вирусным гепатитом, при котором уровень этих ферментов повышается в десятки раз. Изменения в крови, моче и кале у больных раком тела и хвоста ПЖ часто отсутствуют. У 10–52 % пациентов отмечается инсулиновая недостаточность, что проявляется той или иной степенью гипергликемии и связано с одним из следующих факторов: 1) разрушением островкового аппарата растущей опухолью (при локализации опухоли в хвосте), 2) развитием обструктивного панкреатита.
Определение уровня опухолевых маркеров Предложено применение в качестве скрининг‑теста РПЖ определение уровня опухолевых маркеров (ОМ). Наибольший интерес из них представляют карбогидратные антигены СА 19‑9, СА 50, СА 72‑4, Са 125, СА 242, САМ 17‑1 канцерэмбриональный антиген (СЕА); ферменты: GT‑11, эластаза. Достаточно информативным и хорошо изученным является ОМ СА 19‑9. Считается, что при РПЖ этот маркер является не только диагностически значимым, но и с его помощью можно более точно определить стадию рака, оценить эффективность хирургического и химиолучевого лечения, а степень снижения уровня СА 19‑9 после резекции ПЖ по поводу рака является прогностическим фактором, и в этих случаях маркер может быть использован для динамического наблюдения за больными. Диагностическая чувствительность СА 19‑9 при раке ПЖ составляет 73–95 %, специфичность – 63–78 %, эффективность – 76–97 % [1] .
Недостатком СА 19‑9 является то, что его уровень бывает нормальным на ранних стадиях РПЖ, что затрудняет использование этого ОМ для скрининга. Известны случаи, когда и при распространенном РПЖ с множественными отдаленными метастазами уровень СА 19‑9 существенно не повышался или даже оставался в пределах нормы. Это объясняют и тем, что СА 19‑9 и многие другие ОМ – белки эктодермального происхождения, образующиеся у людей, эритроциты которых содержат Lewis‑антиген.
Повышение уровня СЕА при РПЖ чаще всего свидетельствует о метастатическом поражении печени. Пациенты, у которых уровень СЕА больше 15 нг/мл, имеют достоверно меньшую выживаемость. Практически возможности использования СЕА при диагностике РПЖ ограничены, так как его чувствительность составляет 35–62 %, специфичность – 52–77 %, а эффективность – 64–75 %. Учитывая все сказанное, СЕА применяется для повышения эффективности диагностики Р ПЖ в комплексе с другими ОМ.
Недостаточная специфичность ОМ, особенно при небольших, удалимых опухолях, повышение их уровня при неопухолевых заболеваниях печени и ПЖ, колоректальном и некоторых других раках, ограничивает диагностическое значение СА 19‑9, СЕА и других маркеров при РПЖ.
Задачей предоперационной диагностики является не только установление диагноза РПЖ, но и определение стадии заболевания, так как от этого будет зависеть лечебная тактика.
Необходимо различать неинвазивные (УЗИ, ФГС, КТ, релаксационная дуоденография, магнитно‑резонансная томография (МРТ), магнитно‑резонансная холангиопанкреатография (МРХПГ), позитронная эмиссионная томография, эндоультрасонография) и инвазивные методы диагностики РПЖ периампулярной области (лапароскопия, ретроградная холангиопанкреатография, чрескожная чреспеченочная холангиография, тонкоигольная аспирационная биопсия под контролем УЗИ или КТ, ангиография). Исследования проводятся по принципу «от простого к сложному», причем не следует применять инвазивные методы, если диагноз можно поставить, выполнив доступные неинвазивные и малоинвазивные исследования.
Определенный прогресс в диагностике РПЖ, достигнутый за последние годы, связан с появлением в повседневной практике новых инструментальных методов исследований, позволяющих не только установить диагноз, но и во многих случаях определить стадию заболевания.
Первым этапом диагностической программы, направленной на выявление опухоли ПЖ и определение ее распространенности, является ультразвуковое исследование (УЗИ). Характерными признаками РПЖ, по данным УЗИ, являются локальное увеличение размеров органа, наличие опухолеподобного гипоэхогенного образования, бугристые контуры ПЖ в области опухоли (рис. 98).
Важным моментом в ультразвуковой диагностике рака головки ПЖ считается визуализация главного панкреатического протока (ГПП) и определение его диаметра. Даже небольшие опухоли, которые не видны при УЗИ, могут привести к нарушению проходимости ГПП и вторичному его расширению, что является косвенным признаком наличия опухоли. Расширение ГПП выявляют у 85–92 % больных раком головки ПЖ. Диагностическая точность метода составляет 67–86 % и существенно зависит от опыта и квалификации врача, выполняющего УЗИ. Увеличенные регионарные лимфатические узлы при УЗИ можно выявить в 30–47 %, метастазы в печени – в 46–74 %, поэтому его чувствительность в оценке резектабельности не превышает 40 %. Недостаточная эффективность ультразвуковой диагностики РПЖ объясняется и ограниченными до 1–2 см разрешающими способностями ультразвуковых аппаратов. На основании данных УЗИ в большинстве случаев сложно судить об инвазии опухоли в прилежащие структуры, дифференцировать небольшие (до 3 см) раковые опухоли от воспалительных поражений ПЖ.
Существенное значение в диагностике опухолей ПЖ имеет компьютерная томография (КТ). Основными признаками КТ, позволяющими заподозрить РПЖ, являются увеличение размеров железы на локальном участке, бугристые контуры ПЖ в этой области, наличие опухолеподобного гиподенсного узла, опухолевая инвазия перипанкреатической клетчатки. Расширение ГПП при КТ диагностируется гораздо реже, чем при УЗИ, что связано с большой толщиной срезов при КТ (5–8 мм). Диагностическая точность КТ составляет 72–91 %. Разрешающая способность КТ близка к таковой при УЗИ, хотя метод обладает несколько большей информативностью в установлении распространения РПЖ на окружающие органы и структуры, в выявлении регионарных метастазов (рис. 99).
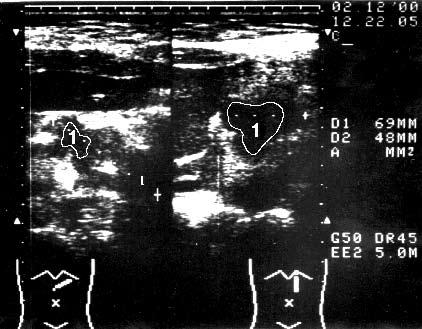
Рис. 98. Ультразвуковое исследование. Рак головки ПЖ. На снимке видна гипоэхогенная бугристая раковая опухоль 5x4 см (1)
Дифференциальная диагностика рака, других опухолей ПЖ и псевдотуморозного хронического панкреатита (ХП) по данным КТ и УЗИ довольно сложна и часто невозможна. Наличие кист в области опухолевого образования, панкреатическая гипертензия встречаются в обоих случаях и не являются дифференциально‑диагностическими признаками. Кальцинаты в проекции опухоли при РПЖ встречаются нечасто. В 95 % кальциноз свидетельствует о ХП. Для выявления опухолей ПЖ КТ предпочтительнее, чем УЗИ, так как дает больше информации о распространении опухоли на смежные анатомические структуры и его результаты не столь зависимы от опыта врача, выполняющего исследование. УЗИ и КТ – взаимодополняющие исследования и их следует применять вместе. В комбинации это позволяет повысить точность диагностики ракового поражения ПЖ до 90 %. 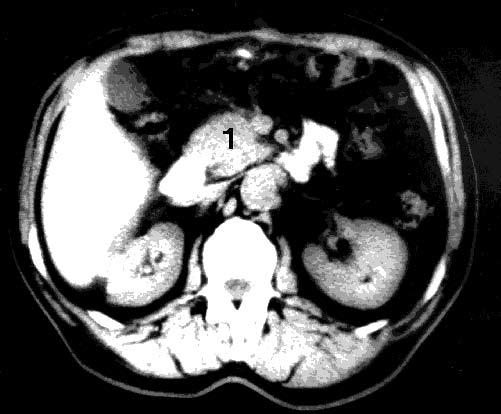
Рис. 99. Компьютерная томография. Рак головки ПЖ. На снимке видна гиподенсная бугристая опухоль головки ПЖ 4x5 см (1)
Недавно появившаяся новая концепция сканирования, названная спиральной компьютерной томографией (СКТ), значительно увеличила возможности диагностики заболеваний ПЖ. В процессе данного исследования происходит спиралеобразное движение веерообразного луча через тело пациента, так как одновременно с движением электронно‑лучевой трубки происходит движение стола. Большая анатомическая область может быть просканирована за один период задержки дыхания пациентом, причем получаются тонкие соприкасающиеся «срезы» толщиной до 3 мм. СКТ обеспечивает создание высококачественных трехмерных реконструкций органов и сосудов вместе с опухолью, что особенно важно для предоперационной оценки резектабельности. При этом исследовании можно выявить образования более 4 мм. Локальная инвазия близлежащих висцеральных сосудов затрудняет и нередко делает невозможным выполнение резекции у большого числа больных РПЖ и поэтому дооперационной диагностике опухолевого прорастания сосудов, в особенности воротной вены, придается большое значение. В комбинации с внутривенным болюсным контрастированием и субтракционной обработкой данных, можно реконструировать СКТ‑ангиограммы, воспроизводящие проекционные трехмерные изображения сосудистого русла и определить резектабельность опухоли с точностью 56–78 %. Считается, что результаты СКТ сопоставимы с таковыми при совместном применении КТ и ангиографии (рис. 100).
При проведении сравнительной оценки разных диагностических методов (КТ, УЗИ, МРТ, ангиография) в ряде исследований выявлено, что по своим диагностическим возможностям МРТ не превосходит другие методы исследования.
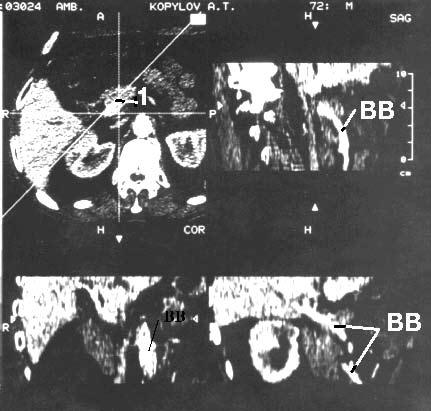
Рис. 100. Спиральная компьютерная томография с портографией. Рак головки ПЖ. На верхнем левом снимке видна гиподенсная бугристая опухоль головки ПЖ 4x5 см (1). На остальных снимках контрастирована воротная вена (ВВ). Отмечается ее прорастание в области опухоли
Магнитно‑резонансная томография (МРТ), по данным большинства исследователей, не имеет существенных преимуществ перед УЗИ и КТ в диагностике заболеваний поджелудочной железы. Кроме того, МРТ отличается более высокой стоимостью. В последние годы появился новый неинвазивный метод – магнитно‑резонансная холангиопанкреатография который позволяет визуализировать желчные и панкреатические протоки без инвазивных вмешательств и введения контрастных веществ. Это исследование осуществимо у всех больных, не дает осложнений и позволяет получить такую же информацию, как и при одновременном применении КТ, ангиографии (АГ) и эндоскопическая ретроградная холангиопанкеатография (ЭРХПГ) (рис. 101. а, б).
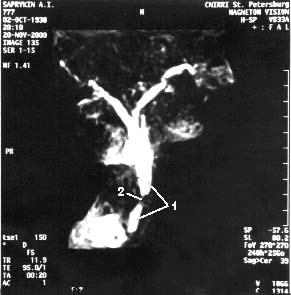
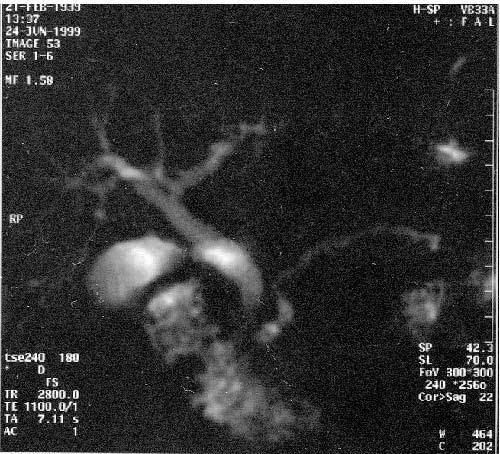
Рис. 101. Магнитнорезонансная холангиопанкреатикография. Рак головки ПЖ. А – отмечается дефект наполнения (2) в панкреатической части холедоха (1) на протяжении 1 см. Опухоль диаметром 1,5 см была выявлена только интраоперационно. Б – отмечается дефект (3) в месте слияния общего желчного (1) и панкреатического (2) протоков. Имеется супрастенотическое расширение протоков. Опухоль диаметром 3 см была выявлена при УЗИ, КТ и интраоперационно
Достаточно достоверные данные о местном распространении опухоли, инвазии сосудов, регионарных метастазах могут быть получены при использовании эндоультрасонографии (ЭУСГ) – нового метода диагностики, эффективность которого широко обсуждается в литературе. При этом исследовании датчик можно подвести непосредственно к опухоли (лапароскопически, через желудок и ДПК, интрадуктально через БДС, интрапортально), что позволяет выявить образования менее 1 см, а при интрадуктальном УЗИ – опухоли до 2 мм, увеличенные лимфатические узлы, инвазию крупных сосудов, выполнить игловую биопсию этих образований. Недостатком ЭУСГ является большая зависимость результатов исследований от опыта врача, выполняющего исследование, что существенно ограничивает его применение и мешает широкому распространению метода (рис. 102). В последнее время значительную роль в решении вопросов диагностики и определении стадии РПЖ играет позитронная эмиссионная томография (ПЭТ). ПЭТ позволяет осуществлять количественную оценку концентрации радионуклидов в опухоли и пораженных ею лимфатических узлах на разных стадиях заболевания.
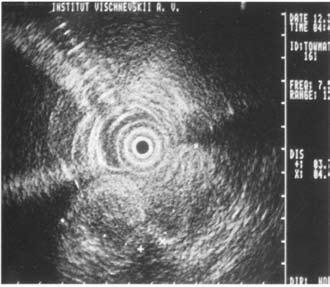
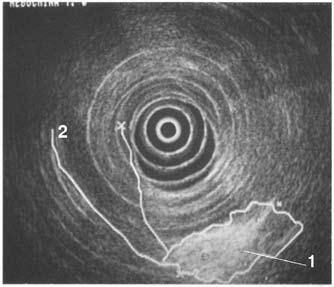
Рис. 102. Эндоскопическое УЗИ. 1. Опухоль головки ПЖ. 2. Расширенный терминальный отдел общего желчного протока
С этой целью для ПЭТ применяются радиофармацевтические препараты, меченные циклотронными радионуклидами. Возможности ПЭТ при обнаружении опухолей менее 2 см, метастазов печени, метастатических лимфатических узлов превышают таковые при КТ. Большинство исследователей применяют ПЭТ при дифференциальной диагностике злокачественных и доброкачественных образований ПЖ. В литературе имеются сведения и о возможности определения при ПЭТ степени злокачественности опухоли в зависимости от интенсивности накопления препарата. Однако для оценки резектабельности ПЭТ не может заменить КТ (рис. 103). Кроме того, ПЭТ не позволяет поставить топический диагноз, поэтому его следует применять в сочетании с КТ. Основным недостатком исследования является необходимость использования дорогостоящей аппаратуры для производства радионуклидов, которые имеют короткий период полураспада (от нескольких минут до двух часов), что требует близкого расположения циклотрона к лаборатории (рис. 104).
К сожалению, большинство из перечисленных методов исследования (кроме ПЭТ) не позволяют с абсолютной точностью установить диагноз РПЖ. При них выявляется лишь объемное образование и/или косвенные признаки его наличия, а какова природа «опухоли» – неизвестно. Только при ПЭТ можно установить злокачественный характер опухоли с точностью 60–90 % (такой разброс цифр объясняется пока еще недостаточным опытом применения этого исследования). Кроме того, ни один из существующих методов исследования не позволяет точно установить распространение раковой опухоли ПЖ на окружающие органы и структуры (в первую очередь сосуды), что важно при предоперационной оценке стадии заболевания для определения лечебной тактики (операция, лучевая терапия, химиотерапия или их сочетание).
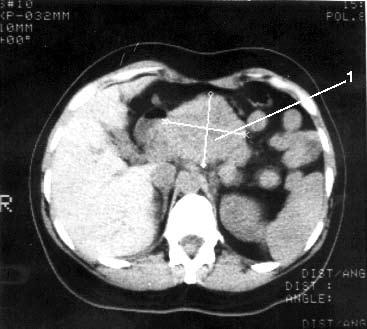
Рис. 103. Компьютерная томография. Рак тела поджелудочной железы. Видна гиподенсная опухоль тела ПЖ с неровными, бугристыми контурами 6x6 см (1)
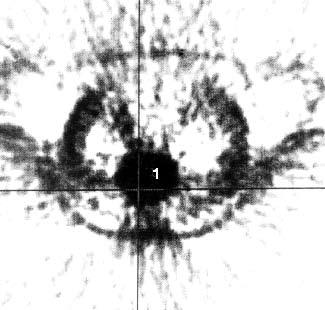
Рис. 104. Позитронная эмиссионная томография той же больной, что и на рис. 12. В проекции выявленной на КТ опухоли отмечается очаг повышенного накопления 18Р‑ФДГ диаметром 6 см с коэффициентом дифференциального накопления опухоль/нормальная ткань (КНД) 2,5–3 (1)
Эндоскопические исследования. При ФГДС диагноз основывается на визуальном обнаружении опухоли, прорастающей стенку полого органа, или на выявлении ее косвенных признаков (деформация и сдавление задней стенки пилороантрального отдела желудка, задневнутренней стенки луковицы и внутренней стенки вертикальной части ДПК, неровность деформированной поверхности стенки и плотность вдавленного участка). Лапароскопия во многих случаях позволяет до операции ориентировочно установить локализацию опухоли, границы ее распространения. Однако, для того чтобы увидеть ПЖ, необходимо применение специальных манипуляторов и приемов (осмотр ПЖ производят через малый сальник, «окно» в желудочно‑поперечноободочной связке). Лапароскопическая картина при опухолевой желтухе характерна: печень, как правило, увеличена, застойна, с зеленоватым оттенком, на ее поверхности можно выявить метастатические узлы. Желчный пузырь при блокаде дистального отдела желчного протока резко напряжен, увеличен в размере. При лапароскопии можно выполнить пункцию желчного пузыря, холецистохолангиографию (третий метод прямого контрастирования желчных путей), холецистостомию с целью декомпрессии и устранения желтухи, наложить микрогастростому для реинфузии желчи, оттекающей через холецистостомический дренаж в послеоперационном периоде.
Рентгенологические исследования. Рентгенологическое контрастное исследование ДПК позволяет выявить патологический процесс, располагающийся не только в самой кишке, но и в органах, непосредственно прилежащих к ней. Применение релаксационной дуоденографии позволяет, как правило, обнаружить опухоль большого дуоденального сосочка и в некоторых случаях, по косвенным признакам, головки ПЖ, а также судить о состоянии стенок самой ДПК. Деформация контуров, сужение просвета ДПК, развернутость ее петли являются косвенными признаками, позволяющими высказать предположение о наличии патологических изменений в ПЖ только в том случае, если опухоль достигнет значительной величины. При РПЖ отклонения от нормы выявляют лишь у 50 % больных (рис. 105).
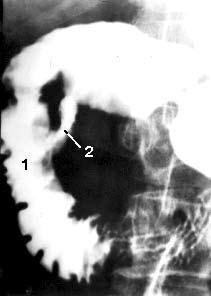
Рис. 105. Дуоденография в условиях гипотонии больной С. По медиальному контуру двенадцатиперстной кишки в верхней половине нисходящей части кишки имеется участок отсутствия рельефа слизистой оболочки на протяжении 2 см (1) и затекание контраста за пределы кишки – полость распавшейся опухоли (2). Макропрепарат после операции (см. рис. 106)
Рентгеноконтрастное исследование желчных путей. Для выяснения причины механической желтухи и определения уровня обтурации желчных протоков используются методы их прямого контрастирования : чрескожная чреспеченочная холангиография чрескожная холецистохолангиография под контролем лапароскопа или УЗИ. Благодаря высокому качеству получаемого рентгеновского изображения прямая холангиография отвечает всем требованиям современной диагностики, позволяя уже до операции выявить и уточнить локализацию обтурирующей опухоли и состояние желчных протоков. При дистальной обтурации общего желчного протока отмечается расширение всей билиарной системы. Контрастное вещество не поступает в ДПК, конфигурация дистального отдела желчного протока имеет вид конического сужения с неровными зубчатыми или фестончатыми контурами, напоминая конец сигары или писчего пера (рис. 107). При раке головки ПЖ, переходящем на панкреатическую часть желчного протока, рентгенологическая тень последнего обрывается в дистальном отделе в виде неровной горизонтальной, полукруглой или конической линии. Если опухоль головки ПЖ распространяется на вышележащие отделы желчного протока, то тень контрастированного желчного протока становится короче, а при вовлечении в процесс пузырного протока желчный пузырь не контрастируется.
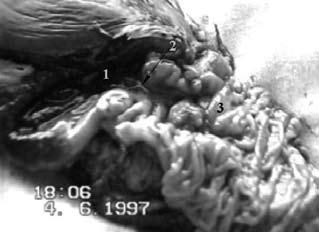
Рис. 106. Макропрепарат той же больной после ПДР. Рак головки ПЖ, прорастающий ДПК (3) и вызывающий резкий стеноз (2) выходного отдела желудка (1).
Другим методом прямого контрастирования желчных и панкреатических протоков является их ретроградное заполнение контрастным раствором при эндоскопической катетеризации Фатеровой ампулы (эндоскопическая ретроградная холангиопанкреатикогра‑фия (ЭРХПГ). Метод был широко внедрен в клиническую практику в 1980‑е годы. Диагностическая точность ЭРХПГ при РПЖ составляет 70–80 %. 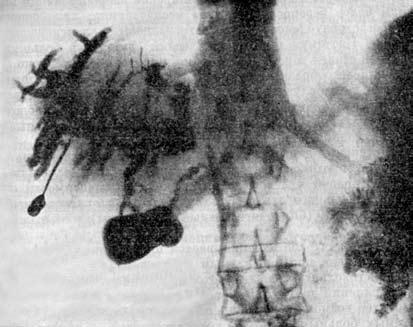
Рис. 107. Чрескожная гепатохолангиограмма: рак головки поджелудочной железы. 1 – игла, 2 – внутрипеченочные желчные протоки, 3 – отключенный (блокированный опухолью) желчный пузырь.
Диагноз основывается на изменениях, обнаруживаемых на панкреатограммах (стеноз или обструкция протока ПЖ), характер которых зависит от размеров опухоли, ее локализации и взаимоотношения с протоковой системой органа. Опухоль, исходящая из эпителия ГПП или располагающаяся в непосредственной близости от него, даже при небольших размерах быстро приводит к изменениям во всей системе протоков. При локализации рака на некотором расстоянии от ГПП изменения в первую очередь возникают в мелких протоках, тогда как в главном протоке их нет (рис. 108). Ангиография (АГ). При РПЖ возникают изменения в ее сосудах или сосудах, расположенных в непосредственной близости к железе: изменяется просвет и положение сосудов, нарушается кровоток, появляются атипичные сосуды. Существует несколько методик контрастирования артерий и вен ПЖ: 1) спленопортография, 2) чрескожная чреспеченочная портогепатография, 3) целиакография. Для опухоли характерны смещение, деформация, окклюзия сосудов. Диагностическая точность метода составляет около 70 % (рис. 109).
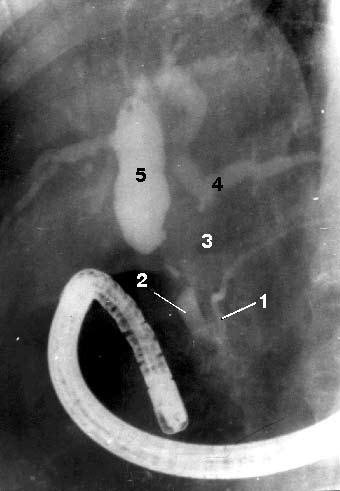
Рис. 108. Эндоскопическая ретроградная холангиопанкреатикография. Рак головки ПЖ, механическая желтуха.
Контрастированы терминальный отдел общего желчного протока (2) и главного панкреатического протока (1) в области головки и тела ПЖ. Общий печеночный проток (4) заполнен контрастом только в месте слияния долевых печеночных протоков, имеется продленный его стеноз в месте опухоли (3). Желчные протоки выше препятствия расширены, увеличение желчного пузыря (5) Биопсия ПЖ. Верификации диагноза при объемных образованиях ПЖ придается большое значение, так как от этого зависит выбор метода лечения. С этой точки зрения для уточнения диагноза или выбора лечебной тактики показана тонкоигольная аспирационная биопсия (ТИАБ) ПЖ под контролем УЗИ или КТ. Метод доступный, относительно безопасный для больного и достаточно надежный.
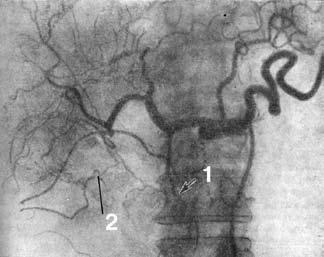
Рис. 109. Целиакограмма: рак головки поджелудочной железы. Артериальная фаза. Ампутация желудочно‑двенадцатиперстной артерии (1), обеднение сосудистого рисунка в зоне опухоли (2).
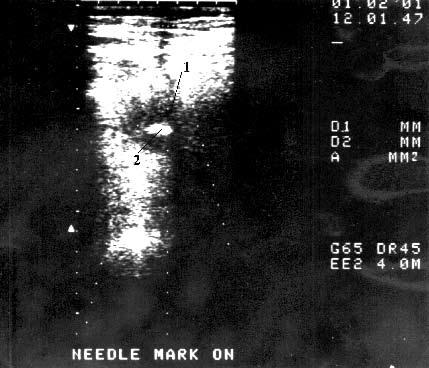
Рис. 110. Тонкоигольная аспирационная биопсия под контролем УЗИ. Рак тела поджелудочной железы. На снимке видна гиподенсная, с неровными, бугристыми контурами опухоль диаметром 4,5 см (1) в центре которой имеется гиперэхогенный участок – кончик иглы (2)
Дооперационная ТИАБ выполняется при дифференциальной диагностике рака ПЖ и ХП, верификации рака ПЖ с целью проведения химиолучевой терапии до или без операции. При этом диагностическая точность ТИАБ составляет 67–96 %. Однако игловую биопсию не рекомендуют применять пациентам, которым предстоит операция, особенно радикальная, так как даже после повторных исследований и получения негативных результатов, особенно при опухолях менее 2 см, нельзя исключить злокачественную опухоль и в маленькие опухоли сложно попасть иглой. Кроме того, имеется опасность имплантационного метастазирования по ходу пункционного канала и опухолевого обсеменения брюшной полости. Исключением является ТИАБ при планировании предоперационной химиолучевой терапии (рис. 110). Есть сведения о применении ТИАБ под контролем эндоультрасонографии. При этом возможна биопсия небольших (менее 2 см) опухолей ПЖ и увеличенных регионарных лимфатических узлов. Диагностическая точность метода при биопсии опухоли составляет 92–97 %, лимфатических узлов – 85–91 %. Из‑за сложности это исследование еще не получило широкого распространения.
Для диагностики и верификации РПЖ в настоящее время, кроме тонкоигольной аспирационной биопсии, применяют интрабилиарную биопсию через чрескожный желчный дренаж, эндоскопическую браш‑биопсию, цитологическое исследование желчи и панкреатического сока, полученных эндоскопически. Диагностическая точность таких исследований достигает 90 %, а специфичность – 100 %.
Как уже упоминалось, ни один из имеющихся в настоящее время методов диагностики РПЖ не дает абсолютно достоверных результатов. Для получения максимальной информации следует проводить комплексное применение нескольких исследований, имеющихся в распоряжении клиницистов. Показано, что если предоперационное определение стадии рака головки ПЖ при помощи КТ, ангиографии и лапароскопии не выявляет признаков нерезектабельности, то резектабельность приближается к 80 %. Диагностический алгоритм РПЖ отличается в каждом конкретном случае и нередко зависит от возможностей учреждения. Но даже при использовании современных методов диагностировать РПЖ и определить его стадию до операции нередко бывает довольно сложно, и истинное распространение опухоли удается установить лишь при лапаротомии.
Диагностический алгоритм рака поджелудочной железы
При подозрении на РПЖ больного первоначально обследуют с помощью УЗИ, КТ, выполняют ФГДС, исследуют уровень опухолевых маркеров СА 19‑9 и СЕА. При выявлении патологии и признаков желчной гипертензии для уточнения диагноза применяют методы прямого контрастирования желчных путей и панкреатических протоков (или МРХПГ), а при подозрении на вовлечение в опухолевый процесс сосудов следует поставить вопрос о проведении селективной ангиографии (портографии) или СКТ‑портографии. Для верификации опухоли выполняют ТИАБ под контролем УЗИ или КТ, а также субоперационную биопсию.
Диагностическая лапаротомия является заключительным этапом диагностики, а в большинстве случаев и лечения РПЖ. Почти у половины больных, у которых на основании данных дооперационных исследований опухоль признается резектабельной, во время ревизии органов брюшной полости и ПЖ выявляют отдаленные метастазы или местное распространение опухоли (в основном на воротную или верхнюю брыжеечную вену). При диагностической лапаротомии, особенно при неподтвержденном диагнозе РПЖ, следует выполнять интраоперационную ТИАБ опухоли ПЖ со срочным цитологическим исследованием полученного материала. Диагностическая точность метода составляет 80–90 % и зависит от размеров опухоли. Трудности возникают при интраоперационной диагностике, когда имеется небольшая (до 3 см) опухоль в толще железы. В клинике были оперированы 57 таких пациентов. На основании ревизии органов брюшной полости, в том числе и с применением биопсии, у них невозможно было исключить РПЖ – во всех случаях была выполнена резекция ПЖ. При этом у половины пациентов при гистологическом исследовании удаленного препарата выявили РПЖ, в остальных случаях – хронический панкреатит. Мы являемся сторонниками выполнения резекции ПЖ при невозможности исключить рак. Разумеется, такая тактика допустима лишь в учреждениях, имеющих большой опыт операций на ПЖ и достигших определенных успехов в снижении послеоперационной летальности.
Дифференциальная диагностика рака ПЖ и хронического псевдотуморозного панкреатита
Наиболее сложной и не решенной до настоящего времени является проблема дифференциального диагноза РПЖ и хронического панкреатита (ХП), особенно при локализации патологического процесса в головке. Определенное значение имеет возраст и пол больных. Пик заболеваемости раком ПЖ приходится на возраст 60–70 лет, а хроническим панкреатитом болеют люди более молодого возраста, обычно 35^5 лет. Подавляющее большинство больных хроническим панкреатитом (более 80 %) – мужчины. Злоупотребление алкоголем на протяжении 10–15 лет до начала заболевания также более характерно для пациентов с ХП.
Почти у всех больных РПЖ (более 90 %) заболевание начинается постепенно, как правило, без каких‑либо провоцирующих факторов. Вместе с тем при ХП большинство пациентов отмечают острое начало заболевания и связь его с алкогольными или пищевыми эксцессами. Длительность клинических проявлений при РПЖ составляет 2–3 мес., а при ХП – более года.
Ведущими симптомами РПЖ и ХП являются боль и потеря массы тела, а для рака головки ПЖ характерна и желтуха.
На основании данных УЗИ и КТ провести дифференциальную диагностику РПЖ и ХП сложно даже в специализированном учреждении.
Уровень СА 19‑9 при РПЖ, как правило, превышает 100 Е/мл, тогда как при ХП такой уровень наблюдается крайне редко, что также может быть использовано при проведении дифференциальной диагностики этих заболеваний.
ТИАБ позволяет выявить опухолевые клетки лишь у 80 % больных РПЖ, поэтому делать выводы, исключающие рак, на основании данных ТИАБ, нельзя.
Перечисленные клинические, лабораторные и инструментальные признаки могут оказать существенную помощь в дифференциальной диагностике РПЖ и ХП, но окончательное заключение нередко возможно лишь во время операции и после планового гистологического изучения удаленного органокомплекса.
Информация, полученная при диагностике РПЖ и дооперационном определении его стадии является основой планирования лечения для каждого конкретного пациента. В результате обследования больных РПЖ выделяют следующие подгруппы:
1) Диагноз РПЖ не вызывает сомнения (в том числе диагноз может быть верифицирован), имеются клинические и инструментальные признаки его распространения (местное распространение или наличие отдаленных метастазов) – 35–40 % случаев:
а) требуется паллиативная операция (по поводу механической желтухи, дуоденальной непроходимости) – 70–80 % больных из этой подгруппы (чаще при раке головки ПЖ);
б) показаний к паллиативной операции нет, возможно проведение лучевой или химиолучевой терапии – 10–15 % больных (в основном при раке тела, хвоста и КО ПЖ) (местнораспространенный рак, больной достаточно сохранный);
в) возможно проведение только химиотерапии – 10–15 % больных (имеются отдаленные метастазы, состояние больного не позволяет провести лучевую терапию).
2) Диагноз РПЖ не вызывает сомнения, признаков его распространения до операции не выявлено, не исключается возможность радикальной операции – 30–40 % случаев.
3) Имеется объемное образование ПЖ, характер которого до операции установить не удалось, но нельзя исключить РПЖ (возможно наличие другой опухоли, хронического псевдотуморозного панкреатита) – 15–20 % случаев РПЖ.
Лечение
Операция является основным методом лечения РПЖ. Однако радикальное вмешательство часто является невозможным из‑за наличия отдаленных метастазов, прорастания магистральных сосудов, тяжести состояния больного (механическая желтуха, печеночная недостаточность). Выполнение операции (даже паллиативной) на высоте желтухи сопровождается высокой послеоперационной летальностью (до 40 %). Улучшению результатов операции, снижению риска развития послеоперационных осложнений, снятию синдрома холемии и желчной гипертензии способствует предварительная декомпрессия желчных путей: лапароскопическая холецистостомия, чрескожная чреспеченочная холецистостомия, чрескожная чреспеченочная холангиостомия, эндобилиарное наружно‑внутреннее дренирование, эндоскопическое транспапиллярное назобилиарное дренирование желчного протока, эндоскопическая папиллосфинктеротомия через опухоль большого дуоденального сосочка. Декомпрессия желчных путей, как правило, способствует быстрой регрессии симптомов холестаза, которая сопровождается положительной динамикой клинико‑лабораторных показателей.
Вторым этапом выполняют радикальную операцию, а при неоперабельности – тот или иной вид паллиативного вмешательства.
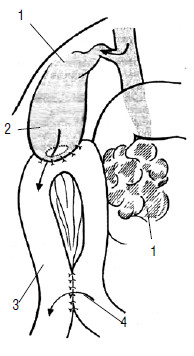
Рис. 111. Холецистоеюноанастомоз с межкишечным анастомозом по Брауну. 1 – опухоль головки ПЖ, 2 – желчный пузырь, 3 – тощая кишка, 4 – межкишечный анастомоз по Брауну, 5 – холецистоеюноанастомоз.
Паллиативные операции составляют до 80 % всех вмешательств, которые выполняют при РПЖ, так как опухоль рано метастазирует и распространяется на близлежащие органы. Они преследуют следующие цели: 1) устранить холестаз и желчную гипертензию, 2) ликвидировать непроходимость желудка или ДПК при наличии таковой, 3) уменьшить болевой синдром. Для устранения механической желтухи применяются различные виды билиодигестивных анастомозов или наружное дренирование желчных путей с реинфузией желчи. Соустье желчного пузыря с тонкой кишкой (операция Монастырского) выполняется при проходимом пузырном протоке. Операция технически несложна и малотравматична, но существенным ее недостатком является опасность развития рецидива желтухи при прорастании опухолью пузырного протока (рис. 111).
Гепатикоэнтероанастомоз производится в случаях, когда опухолевый инфильтрат распространяется по желчному протоку в направлении ворот печени, захватывая пузырный проток и оставляя свободным общий печеночный проток, или только долевые протоки печени. При распространении опухоли в ворота печени иногда накладывают анастомозы с внутрипеченочными желчными протоками (рис. 112).
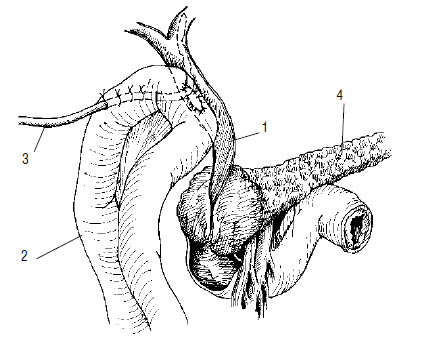
Рис. 112. Схема операции наложения обходного гепатикоеюноанастомоза при раке головки ПЖ, осложненном механической желтухой. Анастомоз сформирован на дренаже, выведенном через анастомозированную кишку. 1 – общий желчный проток, 2 – тощая кишка, 3 – дренаж, 4 – поджелудочная железа, 5 – опухоль головки ПЖ
С целью устранения или предупреждения возникновения явлений непроходимости ДПК производят формирование гастроэнтероанастомоза, чаще – впередиободочного с межкишечным соустьем (рис. 113). Для уменьшения болевого синдрома применяют интраоперационную алкоголизацию чревного сплетения (40 мл 50° спирта). Наружное дренирование блокированного главного панкреатического протока способствует купированию вторичного панкреатита и уменьшению болей.
В последнее десятилетие, в связи с развитием эндовидеохирургии, для уменьшения болевого синдрома и повышения качества жизни больных нерезектабельным РПЖ выполняют торакоскопические спланхникэктомии. Известно, что чувствительные нервные волокна, проводящие болевые импульсы от ПЖ входят в солнечное сплетение, далее в составе внутренностных нервов, в основном больших и через симпатические ганглии следуют в проводящие пути спинного мозга.
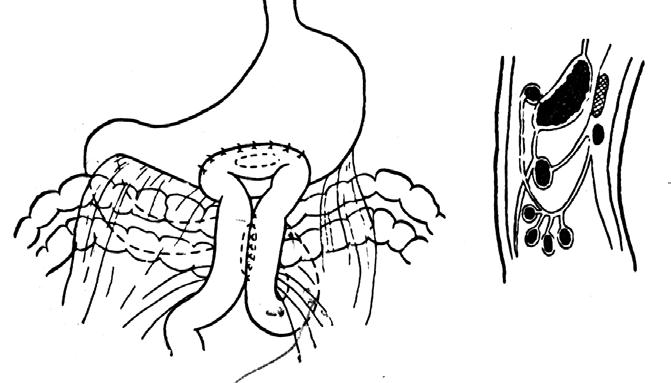
Рис. 113. Передний впередиободочный гастроэнтероанастомоз с межкишечным соустьем по Брауну. 1 – желудок, 2 – гастроэнтероанастомоз, 3 – межкишечный анастомоз по Брауну, 4 – поперечная ободочная кишка
Патогенетическим обоснованием торакоскопической спланхникэктомии является прерывание патологических болевых импульсов от ПЖ путем иссечения участков чревных нервов. Большинство авторов выполняют операцию с левой стороны на уровне ThX‑ThX1 и, если аналгетический эффект недостаточен, операцию через несколько дней выполняют справа. У большинства пациентов удается получить терапевтический эффект – боли уменьшаются в среднем в 2 раза, что способствует повышению качества жизни больных с нерезектабельным РПЖ (рис. 114). Радикальные операции возможны лишь у 6‑30 % больных раком ПЖ. Эти операции технически трудны, что объясняется сложными топографо‑анатомическими взаимоотношениями ПЖ с близлежащими органами и крупными сосудами, в особенности с воротной веной.
Радикальной операцией при раке головки ПЖ считается панкреатодуоденальная резекция (стандартная ПДР, операция Уиппла) – вмешательство, при котором удаляется головка ПЖ вместе с ДПК, дистальным отделом общего желчного протока, дистальной частью желудка (рис. 115). Этапы ПДР представлены на рисунках 114–120.
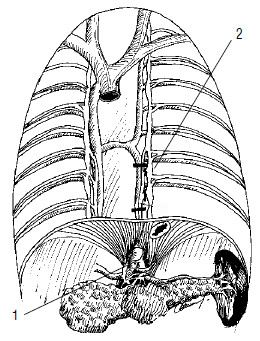
Рис. 114. Схема торакоскопической левосторонней спланхникэктомии с иссечением большого чревного нерва на уровне ThX‑ThX1. 1 – чревное сплетение, 2 – протяженность иссечения большого чревного нерва
Варианты завершения ПДР (реконструктивный этап ПДР) представлены на рисунках 121–123. 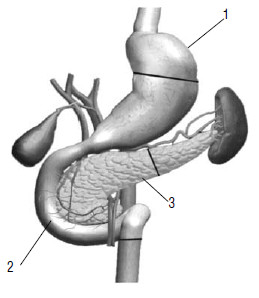
Рис. 115. Классическая панкреатодуоденальная резекция – операция Уиппла. 1 – желудок,
2 –двенадцатиперстная кишка,
3 –ПЖ
Такая операция при небольших (до 2 см) опухолях головки ПЖ может выполняться и без резекции желудка (с сохранением привратника) (рис. 124–125). Существует еще одна методика ПДР: с сохранением и привратника и желчного пузыря, хотя, по нашему мнению, сохранение желчного пузыря при ПДР вряд ли целесообразно (рис. 126–127).
Восстановительный этап операции включает следующие элементы:
1) восстановление непрерывности желудочно‑кишечного тракта путем формирования гастроеюноанастомоза, 2) восстановление пассажа желчи с помощью холедохоеюноанастомоза, 3) обработка культи ПЖ с формированием панкреатикоеюноанастомоза.
При осложнении РПЖ панкреатитом или гнойным холангитом не всегда целесообразно заканчивать ПДР формированием желчного и/ или панкреатического анастомозов с тощей кишкой. Обычно протоки вначале дренируют наружу и лишь на втором этапе вмешательства накладывают билиодигестивный и панкреатикодигестивный анастомозы.
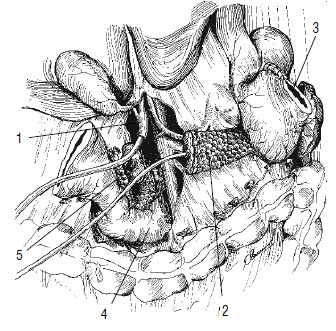
Рис. 116. Удаление панкреатодуоденального комплекса. Пересечена и перевязана гастродуоденальная артерия, пересечен выше угла и отведен влево желудок (3), пересечен общий желчный проток (1) в супрадуоденальной части и в него введена дренажная трубка, пересечена над верхней брыжеечной и воротной веной ПЖ (2), в главный панкреатический проток введена дренажная трубка. Органокомплекс фиксирован на прошитой сшивающим аппаратом УО (справа от верхней брыжеечной вены) двенадцатиперстной кишке (4) и крючковидном отростке (5)
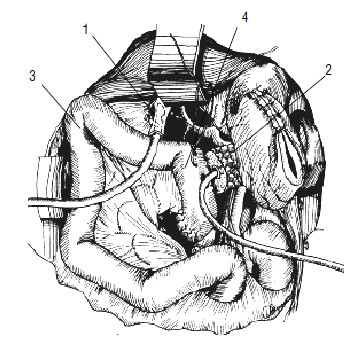
Рис. 117. Реконструктивный этап ПДР. У‑образно отключенная петля тонкой кишки проведена позади ободочной кишки (3) и расположена таким образом, чтобы не было перекрутов и натяжения. Кишка П‑образными швами (4) подшита к культе ПЖ (2), в ней намечено отверстие, совпадающее с главным панкреатическим протоком при подведении кишки к железе. 1 – общий желчный проток 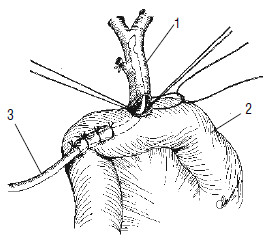
Рис. 118. Реконструктивный этап ПДР. Формирование холедохоеюноанастомоза.
1 – общий желчный проток, 2 – тощая кишка, 3 – дренаж
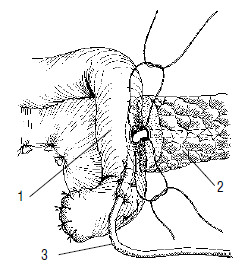
Рис. 119. Продолжение этапа формирования панкреатикоеюноанастомоза. Нитями прошиты задняя стенка главного панкреатического протока и кишка через все слои. Дренажная трубка проведена через просвет кишки и выведена наружу. 1 –тощая кишка, 2 –ПЖ, 3 –дренаж
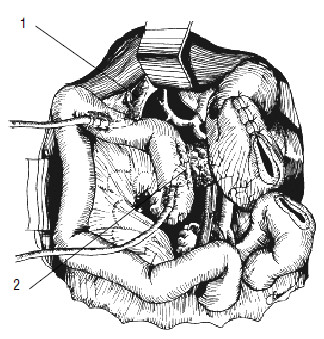
Рис. 120. Панкреатикоеюно‑и холедохоеюноанастомозы сформированы на дренажах. 1 –холедохоеюноанастомоз,
2 – панкреатикоеюноанастомоз
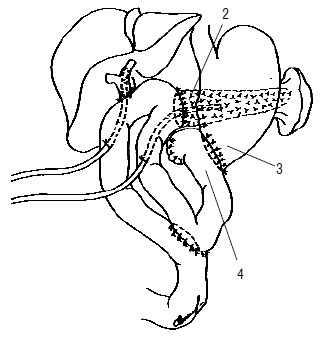
Рис. 121. Вариант завершения ПДР. Сформированы панкреатико– и холедохо(гепатико) еюноанастомозы на отключенной межкишечным соустьем петле тонкой кишки. Наложен гастроэнтероанастомоз, при этом культя двенадцатиперстной кишки расположена забрюшинно (4). 1 – холедохоеюноанастомоз, 2 – панкреатикоеюноанастомоз, 3 – гастроеюноанастомоз 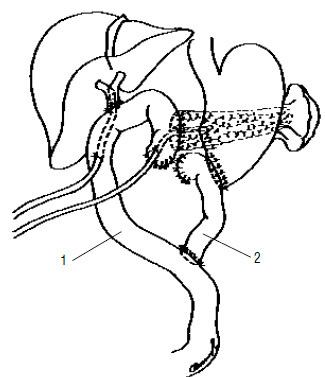
Рис. 122. Вариант завершения ПДР. Сформированы панкреатико– и холедохо(гепатико) еюноанастомозы на отключенной У‑образно петле тонкой кишки (1). Наложен гастроэнтероанастомоз (2), при этом культя двенадцатиперстной кишки расположена забрюшинно 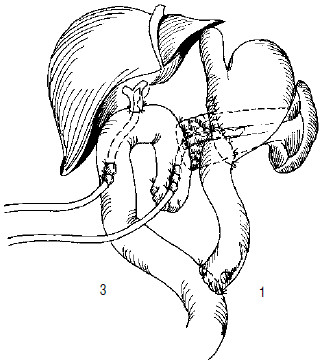
Рис. 123. Вариант завершения ПДР с тотальной дуоденэктомией и наложенными панкреатико– и гепатикоеюноанасто‑мозами на У‑образно отключенной петле тонкой кишки (1). Гастроэнтероанастомоз сформирован по типу «конец‑в‑конец»(2) 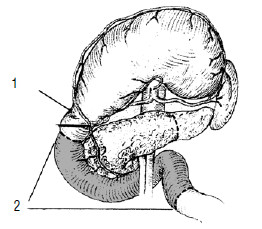
Рис. 124. Пилоросохраняющая панкреатодуоденальная резекция (ППДР). Границы мобилизации и резекции 1 – привратник, 2 – границы резекции.
За последнее десятилетие удалось снизить госпитальную летальность при ПДР до 3–5 %, однако пятилетняя выживаемость составляет лишь 5‑10 %. Отдаленные результаты радикальных операций при раке БДС, терминального отдела холедоха и ДПК значительно лучше – пятилетняя выживаемость составляет 20–50 %. При раке головки и тела ПЖ – выполняется тотальная дуоденопанкреатэктомия (рис. 128), при раке тела и хвоста ПЖ – дистальная резекция G: (рис. 129, рис. 130). Эти операции применяются редко, поскольку рак таких локализаций, как правило, диагностируется слишком поздно.
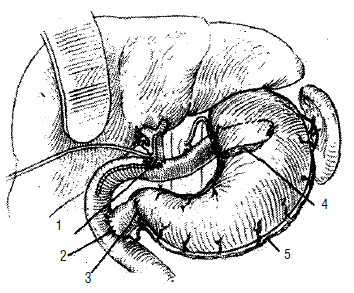
Рис. 125. Реконструктивный этап ППДР. 1 – холедохоеюноанастомоз, 2 – дуоденоеюнонастомоз, 3 – привратник, 4 – панкреатоеюноанастомоз, 5 – желудочно‑сальниковые сосуды
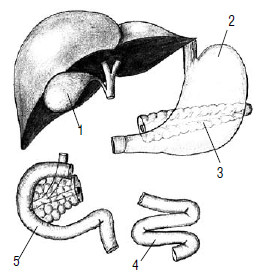
Рис. 126. Схема резекционного этапа операции. 1 – желчный пузырь, 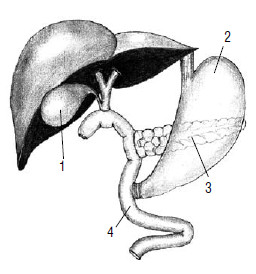
Рис. 127. Схема реконструктивного этапа операции. 1 – желчный пузырь, 2 – желудок, 3 – ПЖ, 4 – тощая кишка 2 – желудок, 3 – ПЖ, 4 – тощая кишка, 5 – удаленный панкреатодуоденальный комплекс 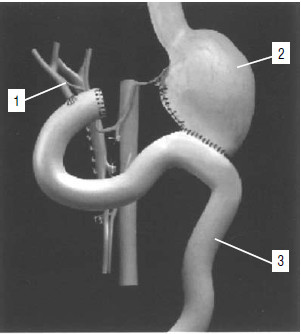
Рис. 128. Тотальная дуоденопанкреатэктомия. 1 – общий желчный проток, 2 – культя желудка, 3 – тощая кишка Реабилитация и лечение больных после панкреатодуоденальной резекции
С современных позиций эффективность оперативного вмешательства должна оцениваться не только частотой послеоперационных осложнений, но и возможностью реабилитации оперированных больных, восстановления утраченной функции и качеством жизни пациентов. ПДР – технически сложное и травматичное оперативное вмешательство, однако лишь она является единственно возможным способом радикального лечения опухолей головки ПЖ и продления жизни больного.
Наиболее выраженные адаптационно‑компенсаторные перестройки в органах гастропанкреатодуоденальной зоны наблюдаются в течение первых 12 месяцев послеоперационного периода. Обследование больных в различные сроки после ПДР (особенно в первые 6 месяцев после операции) показывает, что практически все пациенты при всех сроках наблюдения нуждаются в комплексной медикаментозной терапии.
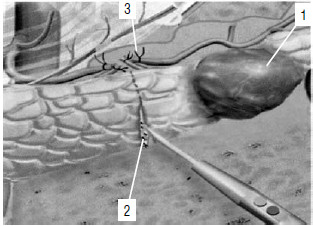
Рис. 129. Дистальная резекция ПЖ – перевязка селезеночных сосудов и пересечение ткани ПЖ. 1 – опухоль, 2 – линия рассечения ПЖ, 3 – пересеченные и перевязанные селезеночные сосуды
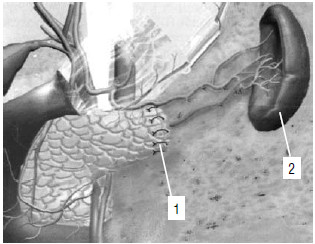
Рис. 130. Дистальная резекция ПЖ с сохранением селезенки. 1 – культя ПЖ, 2 – селезенка
У пациентов нередко имеют место симптомы экзокринной недостаточности (вздутие живота, урчание, учащенный стул, стеаторея), для коррекции которых всем больным необходимы ферментные препараты (в частности креон 25 ООО и 10000 ЕД по 1–2 капсулы с каждым приемом пищи). Пациентам с недостаточными показателями состояния питания (имеющим дефицит массы тела, который рассчитывается по значению индекса массы тела) показана нутриционная поддержка (анаболические гормоны, пищевые смеси или коктейли для энтерального питания), пробиотики при выявлении дисбактериоза кишечника. Наши исследования показали, что проводимая терапия, включающая ферментные, антисекреторные препараты, октреотид, антациды, пробиотики, гепатопротекторы, способствует постепенному повышению качества жизни в течение года после панкреатодуоденальной резекции. В частности, достоверно уменьшается интенсивность болей почти в 3 раза к концу года после ПДР, уменьшается число больных с дефицитом массы тела, нормализуется стул у 3/4 пациентов. У 75 % больных, получающих терапию, отмечаются нормальные показатели копрограммы.
Оценка качества жизни оперированных больных (с помощью международных опросников) продемонстрировала, что уровень состояния общего здоровья и показателей качества жизни постепенно повышаются в течение 12–24 месяцев после операции.
После ПДР у ряда больных (10–20 %, по данным разных авторов) в послеоперационном периоде диагностируется впервые выявленный сахарный диабет, что также требует соответствующей коррекции (назначения диеты, сахароснижающих препаратов или инсулинотерапии).
Сравнительная оценка наиболее распространенных вариантов ПДР убедительно не выявила явных преимуществ или недостатков различных модификаций, с функциональной точки зрения панкреатодуоденальная резекция с сохранением привратника и классическая операция Уиппла (гастропанкреатодуоденальная резекция) являются равнозначными.
Таким образом, при соответствующем лечении уже через год, даже после такой травматичной операции, как ПДР, большинство больных чувствуют себя вполне удовлетворительно.
Комбинированное и комплексное лечение
Как ясно из изложенного, результаты хирургического лечения рака ПЖ нельзя считать удовлетворительными. Это заставляет искать дополнительные методы лечения. К ним относят химиотерапию и лучевую терапию. Основным химиопрепаратом, используемым для лечения рака ПЖ, является 5‑фторурацил, его также применяют в сочетании с лейковорином (производным фолиевой кислоты). В последнее время препаратом выбора является гемцитабин (гемзар). Регионарное введение химиопрепаратов при раке головки ПЖ путем селективной катетеризации под контролем рентгенотелевидения или же во время операции по некоторым данным увеличивает терапевтический эффект и позволяет уменьшить дозу химиопрепарата, вводимого системно.
Лучевую терапию при РПЖ используют в течение последних двух десятилетий. При этом суммарная очаговая доза составляет 50–60 Грей. При небольших резектабельных опухолях возможно проведение предоперационной лучевой терапии крупными фракциями с последующей резекцией. Это позволяет увеличить абластичность операции и в ряде случаев улучшить отдаленные результаты. Перспективной является интраоперационная лучевая терапия. Комбинированное (лучевая терапия и резекция) и комплексное (изолированная химиолучевая терапия, или резекция и химиолучевая терапия, или резекция и химиотерапия) лечение дает возможность заметно улучшить отдаленные результаты лечения.
Дата добавления: 2015-08-26; просмотров: 1232;
