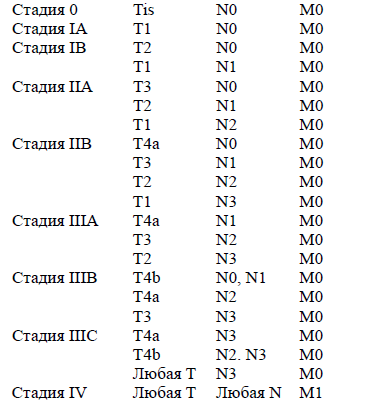
Группировка по стадиям.
Клиническая картина и данные объективного исследования
Симптомы рака желудка весьма разнообразны. Несмотря на отсутствие специфичных, имеются косвенные признаки, указывающие на возможность существования опухоли. Каждый из них должен сразу же насторожить врача. Ранний рак желудка клинических проявлений, к сожалению, не имеет. Все жалобы больных связаны с другими длительно существующими хроническими заболеваниями желудка. Симптомы рака желудка в начале заболевания характеризуются преимущественно теми функциональными нарушениями, которые имеются в доопухолевой фазе развития или типичны для предраковых заболеваний. Основными трудностями ранней диагностики рака желудка являются скрытое течение данного заболевания в доклинической стадии, а жалобы пациентов ничем не отличаются от таковых при доброкачественных поражениях желудка воспалительного или функционального характера. Причем латентное течение бывает весьма длительным, а симптомы появляются по мере роста опухоли.
В зависимости от фона, на котором развивается опухоль, принято различать 3 клинических типа заболевания: 1) рак, развившийся в здоровом желудке; 2) рак, развившийся на фоне язвенной болезни желудка; 3) рак, развившийся на фоне хронического гастрита или полипоза желудка.
Клиническая классификация, предложенная С. А. Холдиным, указывает на частоту отдельных форм рака как в ранней, так и в более поздних фазах. Согласно этой классификации выделяют 4 типа рака желудка: 1) рак с преобладанием местных желудочных проявлений (начиная с незначительных явлений «дискомфорта» и кончая резкими функциональными нарушениями); 2) рак с преобладанием общих нарушений (различной степени выраженности анемии, кахексии, слабости, утомляемости); 3) рак «маскированный», протекающий с симптомами заболеваний других органов; 4) рак бессимптомный (протекающий скрыто).
Эти наиболее удачные клинические классификации подчеркивают ряд моментов, которые следует помнить: 1) карцинома может возникнуть из нормальной слизистой, но также появляется и в результате длительно существующих желудочных заболеваний; 2) опухоли с преобладанием желудочных проявлений встречаются наиболее часто (50–80 %); 3) бессимптомные формы рака при достаточно больших опухолях встречаются чрезвычайно редко.
Первыми проявлениями рака желудка чаще всего бывают немотивированные и нередко неопределенные диспептические жалобы, в других случаях ведущим симптомом может быть прогрессирующая анемия, нарастающая слабость и похудание. В ряде случаев заболевание проявляется желудочно‑кишечным кровотечением. А. И. Савицкий писал об онкологической настороженности и синдроме «малых признаков». Если врач в поликлинике, впервые исследующий больного пожилого возраста, предъявляющего ряд желудочных жалоб, будет «онкологически насторожен», то он сумеет обратить внимание и придать значение самым незначительным проявлениям заболевания, как то: неопределенное чувство тяжести после еды (дискомфорт), отрыжка, иногда незначительные боли. Этого уже достаточно, чтобы направить пациента в онкологический кабинет. В синдром «малых признаков» А. И. Савицкого входят такие симптомы, как утомляемость, усталость, неадекватные выполняемой работе, понижение аппетита, чувство тяжести после еды, прогрессирующее похудание, незначительная анемия, апатия и ряд других. Каждый из этих симптомов непатогномоничен для рака желудка, он встречается и при других заболеваниях, например, при хроническом гастрите. Комбинация этих признаков позволяет заподозрить рак желудка, особенно если речь идет о пожилом больном, и направить его на эндоскопическое исследование с возможной биопсией, которое является решающим в постановке диагноза. Однако, как показал дальнейший многолетний опыт, синдром «малых признаков» больше характерен уже для довольно распространенных форм рака желудка.
Нарастание симптоматики происходит по мере роста опухоли и нарушения вследствие этого функции и структуры органа. При распространении опухоли на зону кардии и пищевод присоединяются дисфагия и обильная саливация. В случае жалоб больного на чувство переполнения в эпигастрии, тошноту и рвоту съеденной накануне пищей есть все основания заподозрить рак нижней трети со стенозом выходного отдела желудка. При упорной рвоте могут развиться выраженные водно‑электролитные расстройства, вплоть до тетании. Раку желудка нередко могут сопутствовать боли в эпигастрии, в правом или левом подреберье. Иррадиация болей в спину или поясницу часто бывает связана с прорастанием опухоли в поджелудочную железу либо метастатическим поражением забрюшинных лимфатических узлов.
Боль в животе – характерный симптом рака желудка, тем не менее он редко бывает начальным признаком заболевания. Часто только через несколько месяцев после появления желудочного дискомфорта присоединяется боль. У больных раком желудка обычно отмечаются ноющие, тупые, разной интенсивности, чаще всего несильные, не связанные с приемом пищи, не имеющие периодичности и сезонности боли в эпигастральной области. Различие болевого синдрома зависит от: 1) размеров опухоли; 2) наличия или отсутствия ее изъязвления; 3) явлений перигастрита и распространения опухоли на соседние органы.
Вторым по значению среди местных проявлений считается диспептический синдром, который находится в прямой зависимости от локализации первичной опухоли. Наиболее часто диспептический синдром наблюдается при опухолях нижней трети желудка, когда вследствие стеноза пилоруса нарушается эвакуация пищи.
По мере роста опухоли и стеноза выходного отдела желудка отрыжка воздухом с неприятным запахом и пищей сменяется рвотой съеденной накануне пищей.
Рак тела желудка длительное время может протекать без выраженных местных признаков. На первый план выступают расстройства общего характера. При изъязвлении опухолей этой локализации может наблюдаться субфебрильная температура, а при опухолях малой кривизны одним из первых проявлений нередко бывает желудочное кровотечение.
Дисфагия – симптом наиболее характерный для рака, который локализуется в кардиальном отделе желудка, но он не может считаться ранним проявлением заболевания.
Наиболее часто карцинома желудка проявляется потерей массы тела, в особенности при раке, который сопровождается стенозом пилоруса. У некоторых пациентов со злокачественными новообразованиями желудка вследствие интоксикации и распада опухоли бывает гипертермия.
Сравнительно длительное развитие опухоли без местных симптомов относится к так называемым «немым» формам болезни и встречается в 2–3% всех случаев рака желудка. Скрытый рак желудка иногда проявляет себя отдаленными метастазами без каких‑нибудь «желудочных» жалоб. С появлением эндоскопической техники ранние и «немые» формы рака желудка стали выявлять при профилактических исследованиях. Как уже упоминалось, каждого больного при наличии рака желудка следует обследовать на предмет выявления отдаленных метастазов: Вирхова, Крукенберга, Шницлера. При наличии отдаленных метастазов в печень пальпаторно она может быть плотной, увеличенной и бугристой. При осмотре живота также необходимо обращать внимание на наличие или отсутствие асцитической жидкости.
В целом полиморфизм клинических проявлений рака желудка зависит от многих причин, главные из которых – форма и локализация опухоли в желудке, строение и скорость развития новообразования, стадия процесса, развитие осложнений, темпы метастазирования.
Клиническая диагностика рака желудка начинается с общего осмотра пациента. Нередко при распространенных формах заболевания обращают на себя внимание бледность и землистость кожных покровов, похудание и снижение тургора кожи. Следует отметить, что при раке желудка у 20–25 % больных развивается железодефицитная анемия. Причинами анемии (наряду с возможной хронической кровопотерей) являются гемолизирующее влияние продуктов распада опухоли, угнетение гемопоэза вследствие атрофии слизистой оболочки желудка, отсутствие соляной кислоты и потеря желудком способности вырабатывать антианемический фактор Кастла. Тщательное изучение анамнеза заболевания позволяет если не установить, то, по крайней мере, заподозрить рак желудка. Выявление в анамнезе язвенной болезни, полипоза желудка, хронического гастрита с выраженной секреторной недостаточностью и анемией (по типу пернициозной) должны привлечь внимание врача так же, как и изменения характера больного.
Пальпаторное выявление образования в эпигастральной области служит важным местным признаком опухоли желудка. У 80–87 % больных в таких случаях удается сделать радикальную операцию, тем не менее, как правило, речь при этом идет об опухолях, которые локализуются в нижней трети желудка и смещаются при пальпации. Если же опухоль локализуется в левом подреберье и неподвижна, то резектабельность при раке желудка сомнительна.
При больших опухолях желудка может определяться притупление перкуторного тона в эпигастральной области. У таких пациентов возможность выполнения радикальной операции весьма сомнительна.
Иногда при прорастании рака желудка в крупные артериальные сосуды выслушиваются систолические шумы при аускультации в верхних отделах живота. Это свидетельствует о местном распространении ракового процесса и, как правило, такие опухоли нерезектабельны.
Среди разнообразных клинических атипичных форм рака желудка в настоящее время выделяют:
1) Анемическая форма – характеризуется гипохромной анемией, наблюдается при экзофитных опухолях;
2) Фебрильная форма – характеризуется немотивированной постоянной лихорадкой;
3) Энтероколитическая форма – сопровождается поносом;
4) Рак кардиального отдела желудка – с течением под маской ишемической болезни сердца;
5) Метастатическая форма рака желудка – проявляется отдаленными метастазами:
а) Асцитическая форма;
б) Печеночная форма (увеличение печени, желтуха);
в) Другие формы рака желудка.
6) Бессимптомный рак желудка – встречается редко (1–2 %). Только детальное исследование больных может выявить признаки рака. Старинное выражение Фрейнда (Freund), что при раке желудка
мы имеем дело с 5‑м актом драмы, первые 4 акта которой проходят незамеченными для врача и для больного, в настоящее время потеряло свое значение, так как сейчас есть много возможностей своевременно распознать рак желудка, а следовательно, и оперировать больных значительно раньше.
Основными осложнениями рака желудка являются кровотечение, перфорация, инфицирование и прорастание опухоли в соседние ткани и органы.
Кровотечение чаще происходит в виде систематической потери небольшого количества крови, выявляемой только химическими пробами (исследование кала на скрытую кровь). Оно является одной из причин анемии. Массивное кровотечение с рвотой кровью и дегтеобразным стулом возникает при опухолях, расположенных на малой кривизне желудка (в области расположения крупных сосудистых ветвей). При кровотечении в случае неэффективности консервативной (гемостатической) терапии даже с паллиативной целью показана резекция желудка или перевязка питающих сосудов на протяжении. Рак желудка нередко осложняется кровотечением из опухоли. По статистике около 10–12 % наблюдений острых желудочных кровотечений – ракового генеза. У каждого шестого умершего в результате желудочно‑кишечного кровотечения на вскрытии выявляют рак желудка. Кровотечене, как правило, наблюдается на поздних стадиях заболевания (при распаде опухоли) и почти у четверти пациентов может быть первым проявлением рака желудка.
Перфорация опухоли в свободную брюшную полость сопровождается клиническими признаками острого живота: внезапной резкой болью в животе, напряжением мышц передней брюшной стенки, выраженной болезненностью при пальпации, положительным симптомом Щеткина‑Блюмберга и другими признаками перитонита. При этом необходима экстренная операция – тампонада перфоративного отверстия прядью большого сальника (так как ушить перфоративное отверстие при раке очень сложно). При относительно благоприятных условиях (отсутствии признаков гнойного разлитого перитонита, резектабельность опухоли) возможно выполнение резекции желудка.
Инфицирование опухоли, лимфатических путей и лимфатических узлов желудка проявляется лихорадкой, интоксикацией и даже сепсисом.
Прорастание рака желудка в соседние органы усугубляет течение заболевания. Желтуха появляется при сдавлении желчевыводящих путей при прорастании опухоли в головку поджелудочной железы, в гепатодуоденальную связку. Прорастание рака в поперечную ободочную кишку ведет к образованию желудочно‑толстокишечного свища. Признаками его являются каловый запах изо рта, рвота с примесью каловых масс (каловая рвота), наличие в каловых массах недавно съеденной пищи.
Лабораторная и инструментальная диагностика
Клиническое исследование крови в раннем периоде болезни редко выявляет какие‑либо изменения. Анемия, как правило, развивается вторично вследствие постоянной кровопотери, недостаточной усвояемости пищевых веществ, в частности железа, при ахлоргидрии, а также при интоксикации (при этом может быть и лейкоцитоз). Изменение состава периферической крови наиболее выражено при метастатическом поражении нескольких органов и бывает при метастазировании в печень и поджелудочную железу, оно менее выражено при забрюшинном прорастании опухоли.
При биохимическом исследовании крови могут быть выявлены диспротеинемия с тенденцией к гипопротеинемии, но чаще эти изменения отмечаются при запущенных стадиях заболевания. Повышение щелочной фосфатазы и увеличение АлАТ и АсАТ в ряде случаев может указывать на наличие отдаленных метастазов, в частности в печени и реже в костях.
Незначительные, скрытые кровотечения сопровождают большинство случаев рака желудка. Наиболее распространенной пробой для выявления «скрытой» крови в кале является проба Грегерсена.
В последние годы для уточнения распространенности опухолевого процесса, особенно при III–IV стадиях заболевания, используют определение концентрации опухолевых маркеров (РЭА, СА 19‑9, СА 72‑4), а также белков острой фазы (орозомукоида, гаптоглобина). Повышение их уровня свидетельствует об увеличении «массы опухолевых клеток», характерном для генерализованных форм заболевания, что в прогностическом плане является неблагоприятным.
Эндоскопическая диагностика получила широкое распространение в связи с разработкой и внедрением в клиническую практику эндоскопов на основе волоконной оптики, которые дают возможность осмотра всех отделов желудка и получения материала для морфологического (гистологического, цитологического) исследования. Эндоскопическая картина раннего рака желудка представлена практически целиком доброкачественными на вид образованиями: полип, зернистое утолщение слизистой желудка (очаговая гиперплазия, одинчнаая, нетипично расположенная «застывшая» складка, эрозии, язва). Из современных методов эндоскопии следует отметить «зум‑эндоскопию», которая позволяет многократно (в сотни раз) увеличивать изображение структуры опухоли при гастроскопии.
Фиброгастродуоденоскопия (ФГДС) с прицельной биопсией имеет преимущество перед рентгенологическим исследованием в выявлении поверхностных, очень маленьких опухолей. В то же время эндоскопический метод уступает рентгенологическому исследованию в выявлении подслизистой инфильтрации стенки желудка, в определении причин и характера деформации органа, часто обусловленных злокачественным процессом и поражением стенки желудка, а слизистая оболочка при этом может быть неизмененной. Эти сужения и деформации могут препятствовать продвижению эндоскопа или просто ограничивать видимость отделов желудка. Поэтому совместное использование рентгенологического и эндоскопического методов исследования является обязательным, поскольку позволяет более глубоко и точно изучать состояние желудка. Современное фиброгастроскопическое исследование дает возможность не только определить локализацию, анатомический тип роста опухоли, но и получить отпечатки с поверхности опухоли и произвести биопсию.
В случаях эндоскопического выявления каких‑либо изменений слизистой оболочки желудка необходимо выполнить биопсию всех подозрительных участков (при этом берут 4–5 биоптатов из каждого такого участка). Причем при язвенных формах рака необходимо произвести забор биопсийного материала как из самой язвы, так и из окружающей ее слизистой оболочки. Гистологическому исследованию следует подвергать не только биоптаты из желудка, но и печени, париетальных диссеминатов, полученных при лапароскопии, а также в результате прицельной биопсии под контролем ультразвукового исследования.
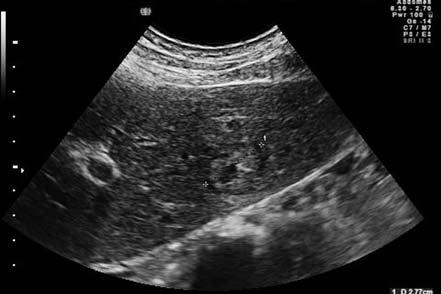
Рис. 62. Ультрасонограмма органов брюшной полости: метастаз рака кардиального отдела желудка в левой доле печени
Ультразвуковое исследование (УЗИ) при раке желудка проводится тремя способами: 1) трансабдоминальное исследование, при котором можно увидеть метастазы в печени, распространение опухоли на поджелудочную железу, увеличенные регионарные лимфатические узлы, да и саму опухоль, если она достаточно больших размеров и доступна визуализации; 2) полипозиционное полипроекционное исследование желудка после заполнения его дегазированной жидкостью для улучшения визуализации стенок органа. При этом можно увидеть саму опухоль и оценить не только ее размеры, но и распространенность; 3) исследование стенки желудка внутриполостным ультразвуковым датчиком, при котором можно оценить глубину инвазии стенки желудка опухолью, состояние перигастральных лимфатических узлов. В целом диагностическая чувствительность ультрасонографического метода колеблется от 70 до 80 %, что позволяет повысить точность дооперационной диагностики, правильно определить стадию опухолевого процесса. УЗИ гораздо более эффективно для выявления метастазов опухоли. Такими признаками являются:
1) Регионарная лимфаденопатия. Отчетливо выявляется увеличение лимфатических узлов в парааортальной клетчатке, в зоне левой желудочной артерии, в парапанкреатической клетчатке по верхнему краю поджелудочной железы и по ходу селезеночной артерии, в воротах печени и селезенки.
2) Очаговые поражения паренхиматозных органов: печени, селезенки, почек, предстательной железы (рис. 62).
3) Наличие локального и тотального асцита.
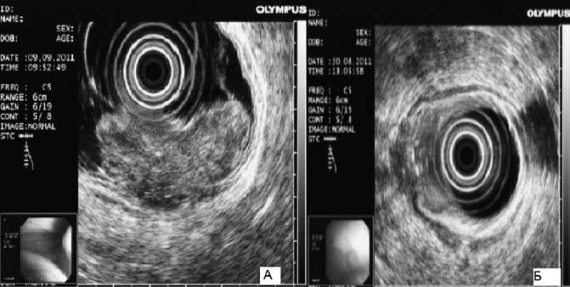
Рис. 63. Эндоскопическая ультрасонография пищевода при раке желудка: А – большая опухоль; В – небольшая опухоль с прорастанием мышечной оболочки
Эндоскопическое ультразвуковое исследование. Эндоскопическая ультрасонография существенно расширяет возможности диагностики рака верхних отделов желудочно‑кишечного тракта. При обследовании больных с опухолями кардиоэзофагеальной зоны эндоскопическое УЗИ позволяет выявить точные границы поражения стенки пищевода и желудка. При этом существенную роль играет решение вопроса о наличии перехода опухоли на пищевод (рис. 63).
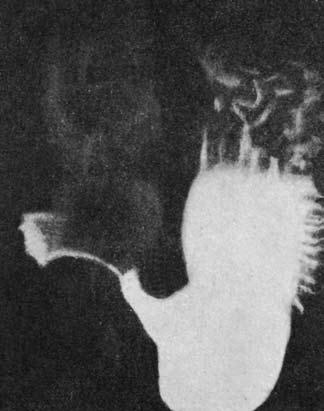
Рис. 64. Рак желудка (рентгенограмма)
Эндоскопическая ультрасонография позволяет выявить даже единичные метастазы в парагастральных лимфатических узлах, в особенности находящихся в зоне поджелудочной железы и в воротах печени. При рентгенологическом исследовании применяют контрастирование барием – рентгеноскопия желудка. На рисунке 64 представлена рентгенограмма больного инфильтративным раком желудка.
Наиболее важными рентгенологическими признаками рака желудка являются выявление: 1) опухоли или дефекта наполнения; 2) потери эластичности желудочной стенки в области опухоли, что ведет к уменьшению или полному прекращению перистальтики; 3) изменения рельефа слизистой оболочки в месте локализации опухоли. При распаде опухоли и образовании кратера последний выявляется в виде депо бария в центре дефекта. Изменения формы желудка вследствие раковой инфильтрации носят разнообразный характер и зависят от локализации, формы и размеров опухоли. Схематично разнообразного рода деформации можно сгруппировать таким образом: 1) желудок в форме рога при расположении опухоли на малой кривизне; 2) в случаях циркулярной инфильтрации антрального отдела он выпрямляется и приобретает форму трубки; 3) при расположении опухоли в субкардиальном отделе или верхней трети тела может возникнуть каскадный желудок; 4) рак, который локализуется в теле желудка (в средней трети его), приводит к деформации по типу восьмерки.
Рентгенодиагностика раннего рака желудка практически невозможна.
Компьютерная томография (КТ) и магнитно‑резонансная томография (МРТ) Несмотря на значительно более высокую разрешающую способность указанных рентгенологических методов, отчетливых преимуществ для определения интраорганного распространения опухоли они не имеют. Дополнительная информация может быть получена для выявления прорастания опухоли в окружающие органы при изменении их формы и взаиморасположения. В сочетании с ангиографией они позволяют судить о прорастании опухоли в крупные кровеносные сосуды. Таким образом, основными МРТ‑симптомами рака желудка являются: а) объемное образование в виде утолщения стенки желудка более 5–7 мм; б) изменение МР‑сигнала от него (гипоинтенсивный и изоинтенсивный); в) однородность МР‑сигнала от образования в обоих режимах исследования при ограниченном процессе и гетерогенность при распространенной форме опухолевой инфильтрации.
КТ и МРТ высокоэффективны для выявления очаговых поражений паренхиматозных органов, увеличенных лимфатических узлов в зонах регионарного метастазирования, а также для оценки состояния лимфатических коллекторов, находящихся в средостении, которые недоступны для исследования более простыми методиками.
Позитронно‑эмиссионная томография (ПЭТ) – новый метод диагностики злокачественных опухолей с использованием различных естественных метаболитов, меченных радиоактивными изотопами. В основе позитронно‑эмисионного сканирования с фтордеоксиглюкозой лежит различие в метаболизме глюкозы между нормальными и злокачественными клетками. 18‑фтор‑2‑дезоксиглюкоза накапливается клетками опухоли в связи с тем, что злокачественные клетки не могут метаболизировать ее в результате фосфорилирования. В отличие от методов структурного сканирования (УЗИ, компьютерная томография, магнитно‑резонансная томография) позитронно‑эмиссионная томография является вариантом функционального сканирования с высокой разрешающей способностью. Следует подчеркнуть, что она применяется не только для дооперационного определения стадии опухоли, но и для оценки результата операции и определения эффективности проводимой химио– и радиотерапии. Лапароскопическую диагностику проводят с целью уточнения глубины поражения опухолью стенки желудка, в частности выхода на серозную оболочку, выявления распространения ее на соседние органы, обнаружения метастазов в печени, асцита и канцероматоза брюшины. Сопоставление лапароскопических данных о прорастании серозного покрова желудка с данными морфологического исследования резецированного желудка показало достоверность метода в 95 % случаев. Лапароскопию следует выполнять всем пациентам раком желудка за исключением случаев раннего рака и осложненного течения заболевания (стенозы входного или выходного отделов желудка, кровотечение), когда оперативное вмешательство предпринимают по жизненным показаниям независимо от лапароскопических находок.
Дифференциальная диагностика
Заболевания, с которыми необходимо дифференцировать рак желудка, можно разделить на две группы: 1) заболевания желудка и 2) заболевания, не связанные с желудком. К первой относят язвенную болезнь, разнообразные формы гастрита, перигастрит, доброкачественные новообразования (полипы, липомы, миомы, фибромы и т. д.), туберкулез, сифилис, актиномикоз, амилоидоз, безоары и др., ко второй – опухоли и кисты печени, поджелудочной железы, внебрюшинные опухоли и новообразования поперечной ободочной кишки. При кардиоэзофагеальном раке, сопровождающемся дисфагией, следует проводить дифференциальную диагностику с заболеваниями пищевода, в первую очередь с ахалазией.
Лечение
Первые резекции желудка по поводу рака были выполнены почти одновременно разными хирургами: Пеаном (Реап) во Франции в 1879 г., Ридигером (Rydygier) в Польше в 1880 г. Эти операции закончились летальными исходами. Лишь 29 января 1881 года профессор венского университета Т. Бильрот (Т. Billroth) впервые произвел успешную резекцию желудка по поводу рака. В России первая резекция желудка была выполнена в Петербурге М. К. Китаевским 16 июня 1881 г. (через 5 VS мес после Т. Бильрота), но со смертельным исходом. Первую успешную резекцию желудка по поводу рака в России выполнил в 1882 году Н.В. Экк. В 1884 г. Коннор (Connor) из Цинциннати (США) впервые выполнил гастрэктомию по поводу рака желудка (с летальным исходом), а в 1897 г. Шлаттер (Schlatter) в Цюрихе впервые с успехом осуществил эту операцию по поводу рака желудка, чем положил начало хирургическому лечениюрака тела и проксимального отдела желудка. Первую гастрэктомию в России произвел известный петербургский хирург, профессор С. П. Федоров в 1902 г., но успешное удаление желудка (гастрэктомия) впервые было выполнено в 1911 г. В. М. Зыковым в Москве.
В настоящее время, несмотря на некоторые успехи комбинированных методов лечения, лишь хирургический метод остается «золотым» стандартом при радикальном лечении рака желудка. Только операция и удаление опухоли позволяет надеяться на полное выздоровление пациента.
Радикальные операции по поводу рака всегда включали обязательное моноблочное удаление регионарных лимфатических узлов. Впервые такой подход был предложен более 100 лет назад Halsted при хирургическом лечении рака молочной железы. С тех пор это положение определяет стратегию онкохирургии в целом и тактику оперативного лечения рака желудка в частности.
Понятие превентивной расширенной лимфодиссекции было впервые введено при хирургическом лечении рака желудка для обозначения вмешательств, сопровождающихся плановым удалением пораженного органа и зон регионарного метастазирования. Следует подчеркнуть, что термин «лимфодиссекция», являясь более емким, нежели термин «лимфаденэктомия», включает моноблочное удаление не только лимфатических узлов, но и всего лимфатического аппарата (лимфатических сосудов с окружающей жировой клетчаткой) в пределах фасциальных футляров.
На основании классификации, с учетом исследований по результатам выживаемости, японские авторы вовлечение лимфатических коллекторов N1‑N2 рассматривают как регионарное метастазирование, тогда как вовлечение лимфатических узлов N3 – как отдаленное метастазирование.
В настоящее время используют классификацию лимфаденэктомии (лимфодиссекции), основанную на категории D (dissection).
а) D0 – резекция с неполным удалением узлов группы N1 (как уже было отмечено, это перигастральные лимфоколлекторы, расположенные в связочном аппарате желудка – № 1–6).
б) D1 – резекция с полным удалением узлов группы N1 (полное удаление вышеуказанных лимфатических узлов – № 1–6).
в) D2 – резекция с полным удалением узлов группы N1 и N2 (к перигастральным лимфоколлекторам связочного аппарата желудка добавляют забрюшинные лимфатические узлы, расположенные по ходу ветвей чревного ствола: по ходу левой желудочной артерии – № 7, общей печеночной артерии – № 8а+р, чревного ствола – № 9, в воротах селезенки – № 10, по ходу селезеночной артерии – № 11 p + d).
г) D3 – резекция с полным удалением узлов группы N1, N2 и N3 (к вышеизложенным лимфатическим узлам N1, N2 следует добавить лимфоузлы гепатодуоденальной связки – № 12а+р+Ь, ретропанкреатодуоденальные – № 13, лимфатические узлы по ходу верхней брыжеечной артерии – № 14а+v, в корне брыжейки поперечной ободочной кишки по ходу средней ободочной артерии – № 15, парааортальные лимфатические узлы, расположенные на различном уровне брюшной аорты – № 16 а1‑а2, b1‑Ь2).
Лимфодиссекции D0, D1 считают стандартными, a D2 и D3 – расширенными. Следует подчеркнуть, что на сегодняшний день лимфодиссекция D2 считается стандартной лишь для японских и нескольких специализированных европейских и американских клиник, так как в большинстве публикаций данная операция рассматривается как расширенная.
В настоящее время во всем мире при раке желудка применяют 3 основных типа радикальных операций: гастрэктомия, проксимальная субтотальная резекция желудка, дистальная субтотальная резекция желудка.
Гастрэктомия (полное удаление желудка и всех зон регионарного метастазирования с гистологическим исследованием линии проксимального и дистального пересечения стенки пищевода и двенадцатиперстной кишки) (рис. 65). Ее выполняют при раке любой макроскопической формы роста, местно‑распространенной опухоли, а также в случаях субтотального либо тотального поражения желудка. Обязательным условием данной операции является наличие в удаленном препарате слизистой оболочки пищевода и 12‑перстной кишки.
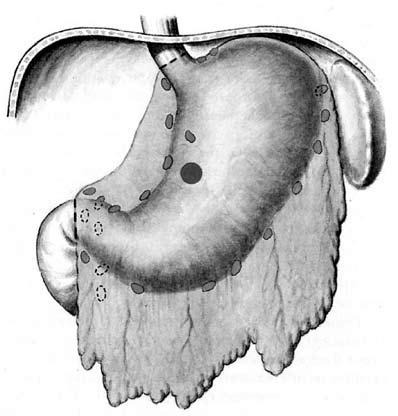
Рис. 65. Объем операции при гастрэктомии.
При распространении опухоли на розетку кардии, абдоминальный или диафрагмальный сегмент пищевода следует одномоментно выполнять резекцию пищевода из комбинированного левостороннего торакоабдоминального доступа. Проксимальную субтотальную резекцию (рис. 66) желудка чрезбрюшинным доступом выполняют только при экзофитной опухоли верхней трети желудка, не распространяющейся на розетку кардии.
Дистальная субтотальная резекция в модификациях Бильрот‑I (формирование прямого гастродуоденального анастомоза) или Бильрот‑II (создание гастроеюнального соустья с односторонним выключением двенадцатиперстной кишки) (рис. 67).
Большинство хирургов отдают предпочтение операции по Бильрот‑II, а некоторые из них – убежденные противники резекции желудка по первому способу Бильрота при раке, считают это вмешательство неадекватным с онкологической точки зрения.
Вместе с тем есть работы, свидетельствующие о том, что по методике Бильрот‑I можно успешно выполнить не только субтотальную дистальную резекцию желудка, но и гастрэктомию с наложением эзофагодуоденоанастомоза с необходимым удалением всего лимфатического аппарата и соблюдением принципа онкологического радикализма.

Рис. 66. Субтотальная проксимальная резекция желудка. Объем операции.
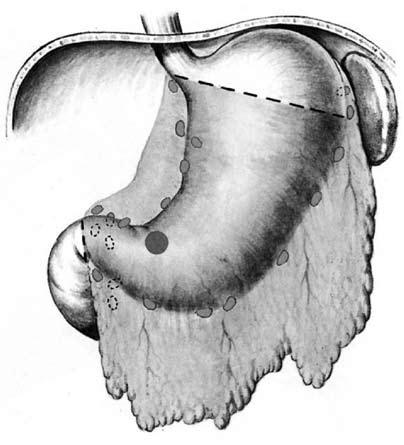
Рис. 67. Субтотальная дистальная резекция желудка. Объем операции.
По этим данным, правильно произведенная мобилизация желудка способствует большей подвижности его культи, что увеличивает шансы формирования гастродуоденального анастомоза без натяжения. Кроме того, гастродуоденальный анастомоз, наложенный при резекции желудка по Бильрот‑I, все же более физиологичен, так как при этом в какой‑то мере сохраняется регуляция желчеотделения при естественном прохождении пищи по двенадцатиперстной кишке. Но основное преимущество этой операции заключается в том, что не происходит прямого контакта желудочной культи со слизистой оболочкой тощей кишки, а это исключает самое неприятное осложнение резекций – пептическую язву соустья. Согласно данным некоторых авторов, использование гастродуоденального анастомоза при раке желудка следует считать оправданным, так как сохранение пассажа пищи по двенадцатиперстной кишке позволяет в значительной мере улучшить функциональные результаты и качество жизни пациентов, обеспечивая в то же время необходимую онкологическую радикальность операции и хороший непосредственный исход. На рисунках 68 и 69 представлены различные модификации резекций желудка по методикам Бильрот‑I и Бильрот‑II.
На рисунке 70 представлены различные способы формирования пищеводно‑кишечных анастомозов при гастрэктомии.
A) Горизонтальный эзофагоеюноанастомоз конец в бок.
Б) Вертикальный эзофагоеюноанастомоз конец в бок с использованием приводящей петли для укрытия швов анастомоза (Гилярович, 1931).
B) Вертикальный эзофагоеюноанастомоз конец в бок с фиксацией к кишке расположенного вдоль нее пищевода специальными швами (К. П. Сапожков, 1946).
Общепризнанным правилом при раке является удаление опухоли в пределах здоровых тканей в едином блоке со всем связочным аппаратом желудка, включающим регионарные лимфатические узлы, наиболее часто и в первую очередь поражаемые метастазами карциномы.
Ю.Е. Березов (1976) в своей монографии приводит данные ряда отечественных и зарубежных авторов о том, на сколько сантиметров от краев опухоли должна отстоять линия резекции, чтобы у онколога была уверенность в радикальности вмешательства. Так, при инфильтративно‑язвенных формах рака желудок следует пересекать отступя не менее чем на 8‑10 см, а при ограниченных, экзофитно растущих формах рака – не менее чем на 6–8 см в обе стороны от пальпируемой границы опухоли. Вместе с тем работами ряда исследователей установлено, что при раке пилорического отдела желудка (в первую очередь при эндофитных формах) возможно распространение опухолевых клеток по лимфатическим сосудам подслизистого и мышечного слоев на начальную часть двенадцатиперстной кишки. В связи с этим необходимо удаление не менее 2–3 см кишки.
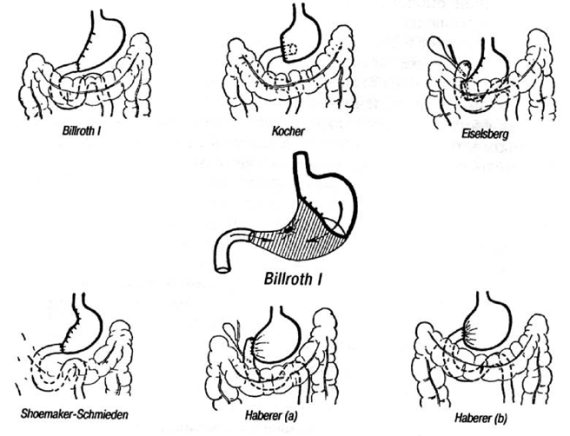
Рис. 68. Операция по Бильрот‑I.
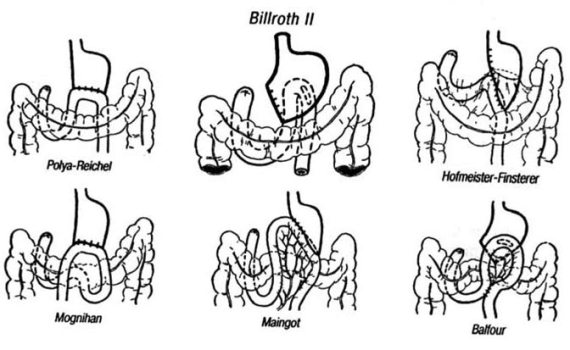
Рис. 69. Операция по Бильрот‑II.
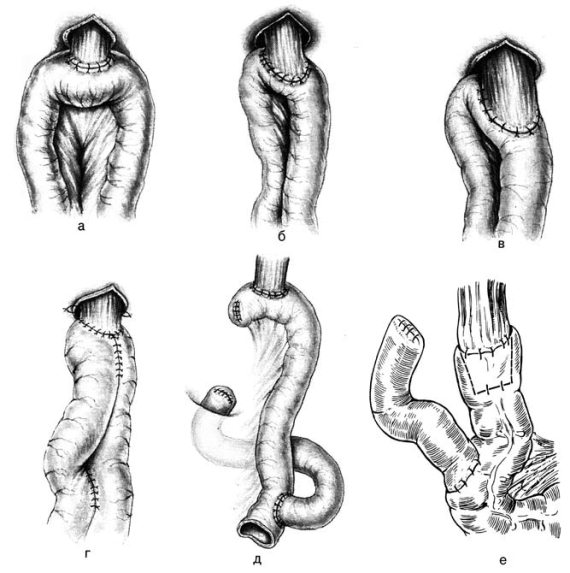
Рис. 70. Основные виды эзофагоеюноанастомоза (схема).
а – горизонтальный пищеводно‑кишечный анастомоз; б – анастомоз по Мак‑Ниру и Пэку; в – анастомоз по Сапожникову‑Юдину; г – анастомоз по Гиляровичу; д – анастомоз по Орру‑Ханту‑Накаяме; е – анастомоз по Цианиди
По мнению Б. Е. Петерсона (1970), субтотальной резекцией желудка считается та операция, при которой удаляют всю малую кривизну желудка от пищевода, а по большой кривизне отсечение органа может проводиться на разных уровнях в зависимости от локализации опухоли и метастазирования в регионарные лимфатические узлы. Большинство авторов рекомендуют отсекать желудок по большой кривизне на уровне нижнего полюса селезенки. А. И. Раковым более 50 лет назад предложена рациональная методика субтотальной дистальной резекции желудка, включающая в себя полное иссечение печеночно‑желудочной связки от пищевода и пересечение левой желудочной артерии у места ее отхождения от чревной (у основания) в толще желудочно‑поджелудочной связки, а также удаление в препарате всего большого сальника. Показанием к субтотальной дистальной резекции желудка является экзофитный рак нижней трети желудка. По строгим показаниям выполнение этой операции допускается при небольших эндофитных или смешанной формы роста опухолях пилороантрального отдела, или когда маленькая экзофитная опухоль локализуется в средней трети желудка. Операцию завершают формированием гастродуоденального или гастроеюнального анастомоза. Чаще применяют методику Бильрот‑II на длинной петле (по Баль‑ФУРУ) с энтеро‑энтероанастомозом между приводящей и отводящей петлями по Брауну с целью профилактики рефлюкс‑гастрита, или на короткой петле (по Гофмейстеру‑Финстереру). Некоторые хирурги отдают предпочтение гастроеюнальному анастомозу на выключенной по Ру петле тонкой кишки.
В настоящее время продолжается поиск новых хирургических подходов, позволяющих надеяться на улучшение отдаленных результатов лечения. Одним из путей решения данной проблемы является повышение онкологического радикализма и резектабельности за счет выполнения комбинированных (при прорастании опухоли в соседние органы) и расширенных оперативных вмешательств. Противопоказанием к радикальному хирургическому лечению рака желудка является IV стадия заболевания. Нередко при этом можно выявить асцит, желтуху и множественные метастазы в обеих долях печени (генерализация опухолевого процесса).
Паллиативные вмешательства при раке желудка имеют важное значение и они направлены на ликвидацию ряда осложнений, значительно отягчающих состояние пациентов, а если они пробные, то оказывают положительное психическое влияние на больного. Эти операции существенным образом не продлевают жизнь больных, но временно улучшают качество жизни и общее состояние. При раке желудка выполняют три основных типа паллиативных вмешательств: паллиативную резекцию, формирование обходных анастомозов и питательных свищей (гастростом).
Паллиативную резекцию желудка выполняют по жизненным показаниям, например, при продолжающемся кровотечении из опухоли, перфорацию опухоли, которую технически невозможно ушить. Выполняют эту операцию при относительно небольших, «подвижных» опухолях в основном выходного отдела желудка по той же методике, что и радикальную, но при наличии отдаленных метастазов (IV стадии заболевания).
Обходной анастомоз является наиболее важной операцией, так как он ликвидирует задержку содержимого желудка: прекращается рвота, исчезают жалобы на тяжесть в эпигастрии, значительно облегчается самочувствие и больной верит в излечение. При раке нижней трети желудка обходной анастомоз – несложное вмешательство, и оно дает хорошие результаты. Ряд хирургов рекомендует заднее соустье, другие – переднее. Чаще всего накладывают передний анастомоз на длинной петле с межкишечным соустьем по Брауну.
Анастомоз между желудком и тонкой кишкой следует накладывать слева (проксимальнее) от опухоли на расстоянии 5–6 см от нее, чтобы предупредить прорастание рака в анастомоз. Учитывая, что иногда имеются очаги рака в сальнике, для наложения соустья необходимо выбрать петлю тонкой кишки длиной 60–70 см.
Гастростомня (свищ для питания больного) при раке кардии является основным паллиативным вмешательством.
Лучевая терапия
Применение лучевой терапии рака желудка как самостоятельного метода лечения считают малоэффективным. Чаще используют комбинированный метод лечения – лучевую терапию в сочетании с хирургическим вмешательством. Обычно применяют предоперационное облучение проксимальных отделов желудка.
Химиотерапия
Химиотерапию проводят при первично‑нерезектабельном раке желудка, рецидивах и метастазах опухоли, а также после выполнения паллиативных оперативных вмешательств, пробных лапаротомий. Чаще всего для лечения применяют 5‑фторурацил (5‑ФУ) и фторафур (ингибиторы ферментов из группы пиримидина) как в виде монотерапии, так и в составе различных схем полихимиотерапии. Больным с наличием отдаленных метастазов, которым выполнено паллиативное вмешательство в объеме радикального, проводят дальнейшую химиотерапию как основной способ лечения. В последнее время при распространенном раке желудка применяют митотические яды – таксаны (таксол, таксотер).
Иммунотерапия
Активную иммунотерапию проводят в сочетании с хирургическим лечением рака желудка. Больных иммунизируют 3–5 мл аутовакцины четырехкратно, начиная с первой недели после операции, и затем с интервалом в одну неделю.
Профилактика рака желудка базируется на своевременном выявлении и адекватном лечении предраковых заболеваний и раннего рака желудка. Основной задачей в этом вопросе является активное выявление больных с данной патологией. Возникает необходимость выделения групп риска, включающих пациентов с пограничными изменениями слизистой оболочки желудка. Следует отметить, что помимо активной вторичной профилактики рака желудка и методов массового скрининга населения первостепенное значение сохраняет правильное обследование пациентов, обращающихся к врачу с патологией желудочно‑кишечного тракта на этапах амбулаторно‑поликлинической помощи.
Прогноз и отдаленные результаты хирургического лечения рака желудка зависят от стадии опухолевого процесса, макроскопической формы и гистологической структуры карциномы, локализации опухоли. Самые лучшие отдаленные результаты получены при хирургическом лечении локальных форм рака. Результаты лечения больных раком желудка отличаются в различных странах мира, что может объясняться особенностями разных хирургических школ и преимущественной преверженностью чисто хирургическому или комплексному методу лечения, а прежде всего, более ранней диагностикой рака желудка в этих странах. Пятилетняя выживаемость при I стадии заболевания составляет 70–95 %, при II – 30–50 %, при III стадии 5‑15 %.
Комбинированное лечение операбельного рака желудка увеличивает продолжительность безрецидивной жизни больных.
Саркома желудка
Среди всех опухолей желудка в 1–2% встречаются саркомы. Различают ангиосаркомы, богатые сосудами, плотные фибросаркомы, в основном состоящие из соединительной ткани, и лимфо‑саркомы. При этом рост опухоли начинается из субмукозного, мышечного или субсерозного слоя и протекает экстрагастрально – в сторону большого сальника или брыжейки поперечной ободочной кишки. Саркомы желудка часто осложняются кровотечением.
Метастазы при саркоме бывают реже, чем при раке, вместе с тем, перфорация опухоли и последующее поступление желудочного содержимого в свободную брюшную полость происходит чаще.
Клиническая картина и данные объективного исследования
Мало отличается от клиники рака желудка. Инструментальная дооперационная диагностика иногда возможна на основании формы и топографии новообразования: выявление ограниченного (чаще на основании данных рентгеноскопии желудка, УЗИ и КТ органов брюшной полости), значительных размеров, экстрагастрального типа опухоли большой кривизны желудка дают основание заподозрить саркому. Окончательная диагностика возможна только после гистологического исследования (следует иметь в виду, что слизистая оболочка желудка при саркоме нередко может быть интактной, результаты гистологического исследования ложноотрицательными).
Лечение
Лечение только хирургическое. Производят резекцию желудка или гастрэктомию по онкологическим правилам, как и при раке желудка.
Дата добавления: 2015-08-26; просмотров: 1114;
